譜系示蹤系列第三期之多重組酶介導的交叉報告基因方法
上期講述的單重組酶報告基因系統只能依賴一個 Maker 來定位我們的目的細胞,如果沒有特定細胞類型特有的基因,則無法通過常規方法對其進行特異性標記。
往期推文:
【譜系示蹤系列第一期】基礎細胞標記方式
【譜系示蹤系列第二期】單重組酶介導的多色報告系統方法
但隨著細胞分類的不斷深入,我們往往需要兩個甚至兩個以上的 Maker 才能準確定位我們想要研究的細胞群體,并且在一個細胞群中靶向兩個基因啟動子可能比依賴傳統報告系統中常用的單個啟動子更精確。這時標記細胞就需要使用到多重組酶介導的遺傳方法。
控制由兩個啟動子驅動的受限制報告基因表達需要兩種不同的重組酶系統,例如 Cre-loxP、Flp-frt、Dre-rox 和 Nigri-nox 等。目前已經開發了多種雙重組酶介導的遺傳標記系統,以增強特異性和同時標記的細胞類型數量,目前常見的可分為交叉報告基因類型、獨家報告基因類型和嵌套報告基因類型。
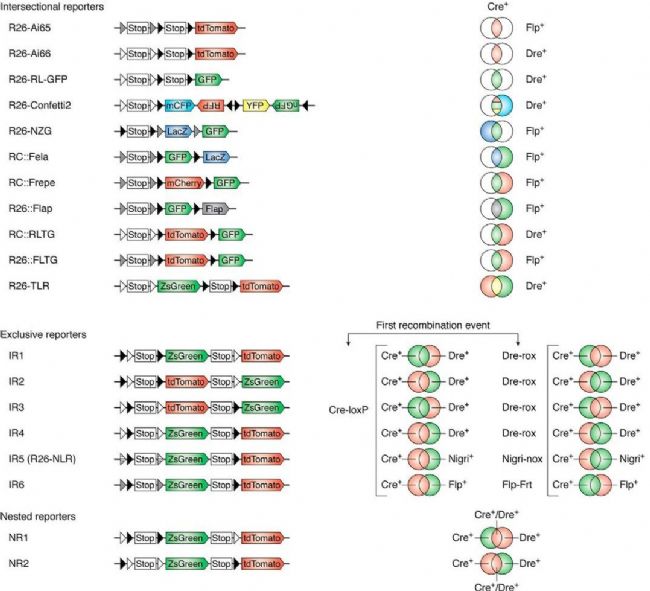
圖. 多重組酶介導的基因重組系統[1]
本期鼠博士為大家講解多重組酶介導的交叉報告基因類型。
交叉報告基因系統
為了精確標記一個細胞群,有時使用兩個細胞特異性 maker 來定義細胞群,例如細胞特異性 makerA 與細胞特異性 makerB 雙陽性的細胞(簡稱為A+B+ Cell)。如何使用合適的報告基因標記系統,特異性標記這類型細胞呢?這時就需要用到交叉報告基因系統。
交叉報告基因系統用于標記兩個 maker 雙陽性的細胞類型,根據其標記顏色也可分為單色報告系統與多色報告系統。
單色報告系統
交叉報告基因小鼠與細胞特異性 makerA 的 Cre 鼠、細胞特異性 makerB 的 Dre 鼠進行交配。得到的小鼠體內的兩個 maker 雙陽性的細胞被標記為單色,其他細胞不被標記上顏色。
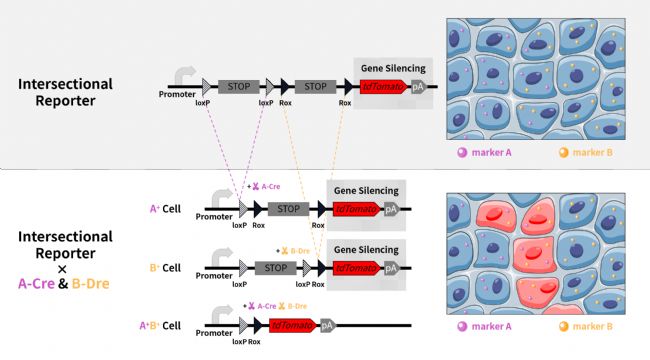
1 A-B- 細胞:
該系統按照啟動子的方向,遇到stop序列被終止表達,細胞未被染色。
2 A+B- 細胞:
makerA 介導 Cre 酶表達,Cre 酶會切除兩個 loxP 位點之間的序列(第一個 stop 序列被切除),之后,該系統按照啟動子的方向,遇到第二個 stop 序列被終止表達,細胞未被染色。
3 A-B+ 細胞:
makerB 介導 Dre 酶表達,Dre 酶會切除兩個 Rox 位點之間的序列(第二個 stop 序列被切除),之后,該系統按照啟動子的方向,遇到第一個 stop 序列被終止表達,細胞未被染色。
4 A+B+ 細胞:
makerA 介導 Cre 酶表達,Cre 酶會切除兩個 loxP 位點之間的序列(第一個 stop 序列被切除),makerB 介導 Dre 酶表達,Dre 酶會切除兩個 Rox 位點之間的序列(第二個 stop 序列被切除),之后,該系統按照啟動子的方向,表達紅色熒光 tdTomato。
因此,僅A+B+細胞可被標記為紅色。
案例1
下圖中就是通過兩個細胞特異性標記特異性標記了細支氣管肺泡干細胞 (BASC)。BASC 是位于細支氣管肺泡管交界處的多能干細胞,它們共同表達細支氣管細胞標志物 Scgb1a1(也稱為 CC10)和肺泡2型細胞標志物 Sftpc。由于缺乏專門定義 BASCs 的單一最佳標記基因,無法使用傳統的 Cre-loxP 介導的譜系追蹤方法追逐 BASCs 的分化命運,而通過雙標志物就可以特異性地追蹤Scgb1a1+Sftpc+ BASC。
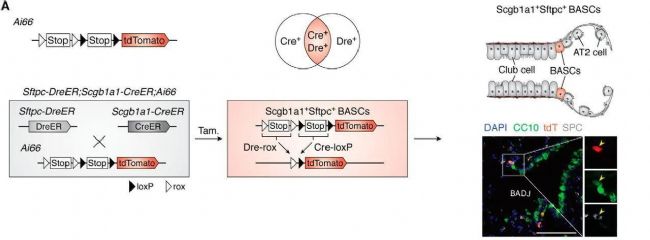
圖. 單色交叉報告基因系統[1]
多色報告系統
為了通過使用其他顏色同時對多種細胞類型(細胞群及其亞群)進行遺傳標記,交叉遺傳報告基因系統會結合兩個或多個報告基因。
交叉報告基因小鼠與細胞特異性 makerA 的 Cre 鼠、細胞特異性 makerB 的 Dre 鼠進行交配。得到的小鼠體內的 A+B- 單陽性細胞、A-B+ 單陽性細胞、A+B+ 雙陽性細胞被標記為三種不同的顏色,其他細胞不被標記上顏色。
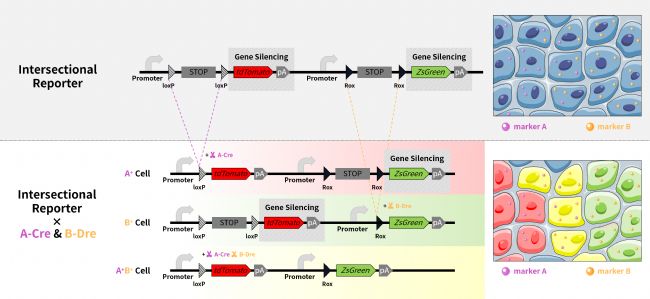
1 A-B- 細胞:
該系統按照啟動子的方向,遇到 stop 序列被終止表達,細胞未被染色。
2 A+B- 細胞:
makerA 介導 Cre 酶表達,Cre 酶會切除兩個 loxP 位點之間的序列(第一個 stop 序列被切除),之后,該系統按照第一個啟動子的方向,表達紅色熒光 tdTomato。
3 A-B+ 細胞:
makerB 介導 Dre 酶表達,Dre 酶會切除兩個 Rox 位點之間的序列(第二個 stop 序列被切除),之后,該系統按照第二個啟動子的方向,表達綠色熒光 zsGreen。
4 A+B+ 細胞:
makerA 介導 Cre 酶表達,Cre 酶會切除兩個 loxP 位點之間的序列(第一個 stop 序列被切除),makerB 介導 Dre 酶表達,Dre 酶會切除兩個 Rox 位點之間的序列(第二個 stop 序列被切除),之后,該系統按照啟動子的方向,表達紅色熒光 tdTomato 與綠色熒光 zsGreen,兩個蛋白的顏色重疊后,呈現出黃色熒光。
因此,A+B- 細胞被標記為紅色;A-B+ 細胞被標記為綠色;A+B+ 細胞可被標記為黃色。
案例2
如下圖中,細支氣管細胞標志物 Scgb1a1 陽性的細胞會被標記為紅色,肺泡2型細胞標志物 Sftpc 的細胞會被標記成綠色,而雙陽性的細支氣管肺泡干細胞 (BASC)由于同時表達紅色與綠色熒光而被標記為黃色。這樣可以通過不同的顏色準確區分不同來源的細胞,增強對細胞群命運可塑性的理解。
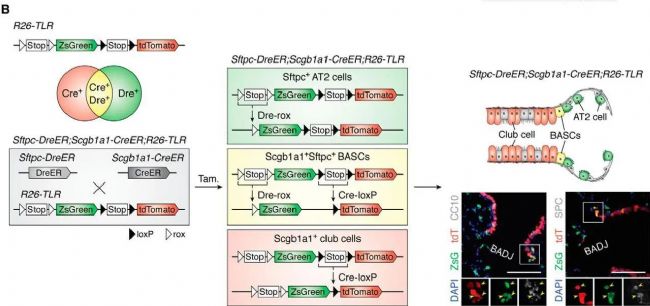
圖. 多色交叉報告基因系統[1]
上述講述的是多重組酶報告基因系統的交叉報告基因類型,主要用于標記雙陽性的細胞類型,但其他類型的細胞應該如何標記呢?下一期鼠博士為大家講解多重組酶報告基因系統的獨家報告基因類型。
Reference:
[1] Liu K, Jin H, Zhou B. Genetic lineage tracing with multiple DNA recombinases: A user's guide for conducting more precise cell fate mapping studies. J Biol Chem. 2020 May 8;295(19):6413-6424. doi: 10.1074/jbc.REV120.011631. Epub 2020 Mar 25. PMID: 32213599; PMCID: PMC7212637.
關于我們
上海南方模式生物科技股份有限公司(Shanghai Model Organisms Center, Inc.,簡稱"南模生物"),成立于2000年9月,是一家上交所科創板上市高科技生物公司(股票代碼:688265),始終以編輯基因、解碼生命為己任,專注于模式生物領域,打造了以基因修飾動物模型研發為核心,涵蓋多物種模型構建、飼養繁育、表型分析、藥物臨床前評價等多個技術平臺,致力于為全球高校、科研院所、制藥企業等客戶提供全方位、一體化的基因修飾動物模型產品解決方案。





