一種細胞外囊泡通用標記方法之聚糖錨定熒光標記策略的研究與介紹
在細胞外囊泡(EVs)的眾多來源中,牛奶來源的細胞外囊泡(milk-derived extracellular vesicles, mEVs)因其來源豐富、具有天然的生物活性和生物相容性等特性,被視為有潛力的下一代治療遞送平臺。mEVs 被開發用于口服藥物遞送的載體,保護治療藥物免受胃腸道降解,改善腫瘤的靶向治療。然而,要充分挖掘 mEVs 的治療潛力,需深入探究其細胞攝取行為及在細胞內的轉運過程,這需要依賴可靠的標記技術。目前,常用的熒光標記方法存在諸多問題:例如,親脂性染料標記存在染料脫落、自聚集、轉移以及影響囊泡完整性等問題;常用的共價標記技術,如N-羥基琥珀酰亞胺(N-hydroxysuccinimide, NHS)酯染料標記,需要借助蛋白表面的伯胺,可能會改變囊泡表面蛋白的功能;基因工程標記則不適用于非培養來源的囊泡(如 mEVs),在實際應用中受到限制。因此,開發一種簡單、穩定且對囊泡結構和功能影響較小的標記方法顯得尤為關鍵。
日前,集美大學陳超翔教授團隊在 Small Methods 發表題為“Glycan-Anchored Fluorescence Labeling of Milk-Derived Extracellular Vesicles for Investigating Their Cellular Uptake and Intracellular Fate”的文章,報道了一種“聚糖錨定”熒光標記策略。該策略通過氧化 mEVs 表面的唾液酸殘基,與熒光染料共價連接,從而實現對 mEVs 的高效標記。經納米流式(NanoFCM)分析證實該方法的標記效率近 100%,且 mEVs 的完整性和生物功能不受影響。這一創新的標記技術為深入研究 mEVs 的細胞攝取、細胞內轉運機制以及藥物遞送效率提供了有力的支持,有望推動基于 mEVs 的新型藥物遞送系統的研發和臨床應用。
01 聚糖錨定熒光標記策略
研究者通過高碘酸鹽氧化 mEVs 表面的唾液酸產生醛基,再經苯胺催化與含酰肼功能化的熒光團(Cy5-酰肼)進行共價結合,實現熒光標記(圖1a)。然后,利用 NanoFCM 對標記后的 mEVs 進行分析,熒光檢測顯示約 100% 的 mEVs 成功標記了 Cy5,證實該方法具有極高的標記效率(圖1c, d)。同時,研究發現該標記不影響 mEVs 的物理性質、蛋白標志物和細胞攝取能力,且在不同溫度和 pH 條件下穩定性良好,對多種來源的 EVs 均適用(圖2)。
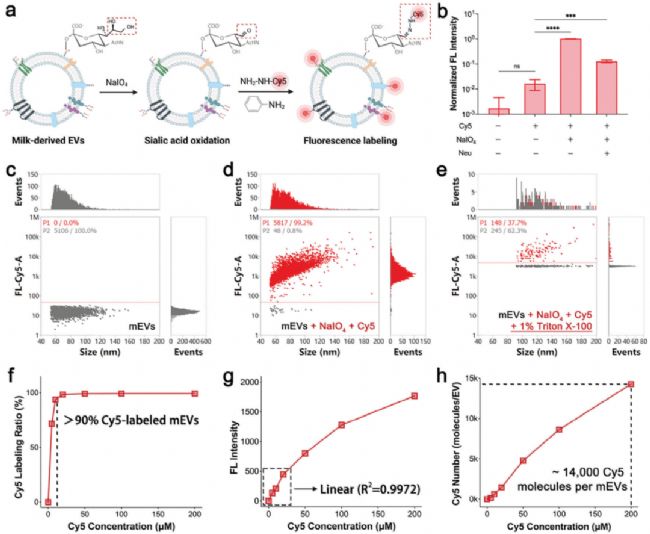
圖1. NanoFCM 評估聚糖錨定熒光標記 mEVs 的效率
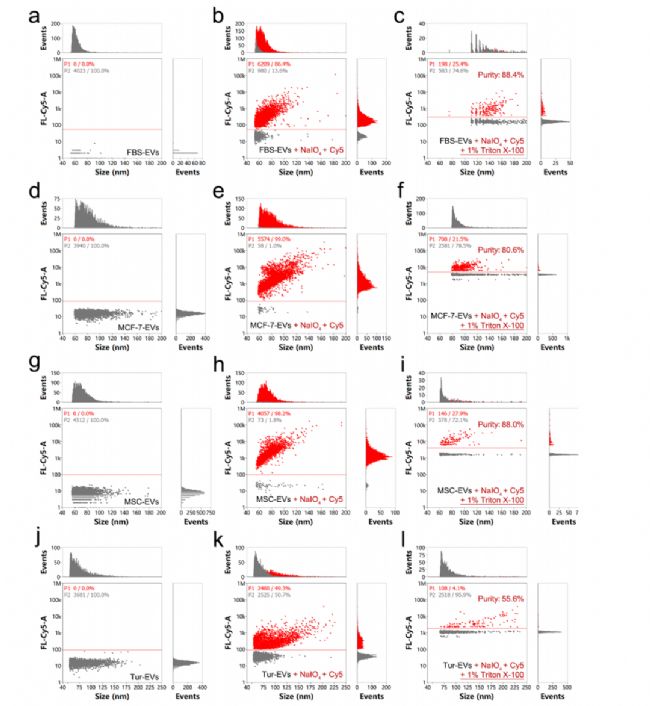
02 與親脂性標記方法的對比
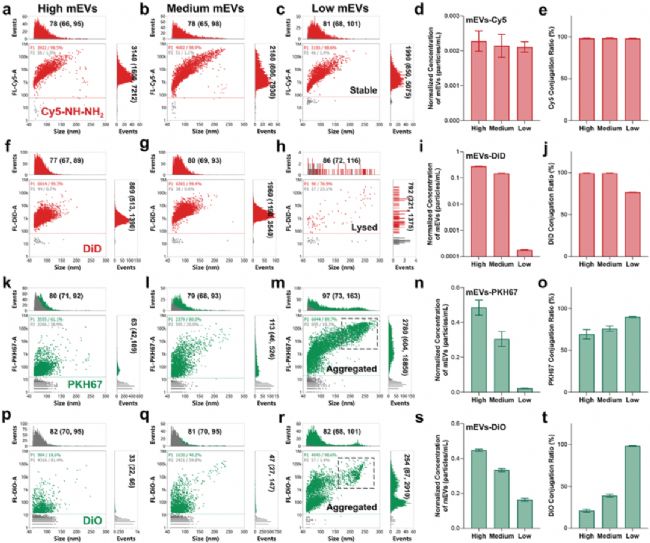
研究者利用 NanoFCM 對聚糖錨熒光標記方法與親脂染料標記方法從標記效率、穩定性以及對囊泡特性的影響進行系統比較。結果顯示,聚糖錨定標記法在所有測試的 mEVs 濃度下,均展現出近乎 100% 的標記效率,且不會引發囊泡的聚集或裂解(圖3a-d),充分顯示出該方法的高效性與穩定性。而親脂性染料(如 DiD、PKH67、DiO)的標記效果則因濃度依賴性導致結果不穩定,低濃度時標記效率不足,高濃度則導致 mEVs 聚集、裂解和染料自聚集(圖3)。
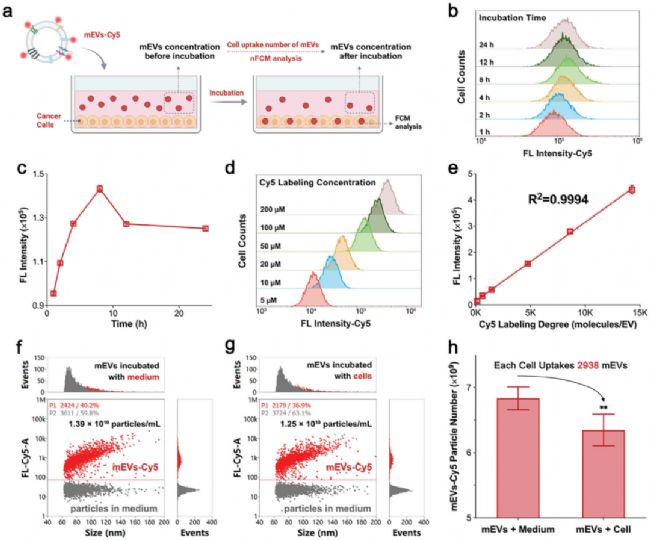
03 mEVs 的細胞攝取和胞內轉運
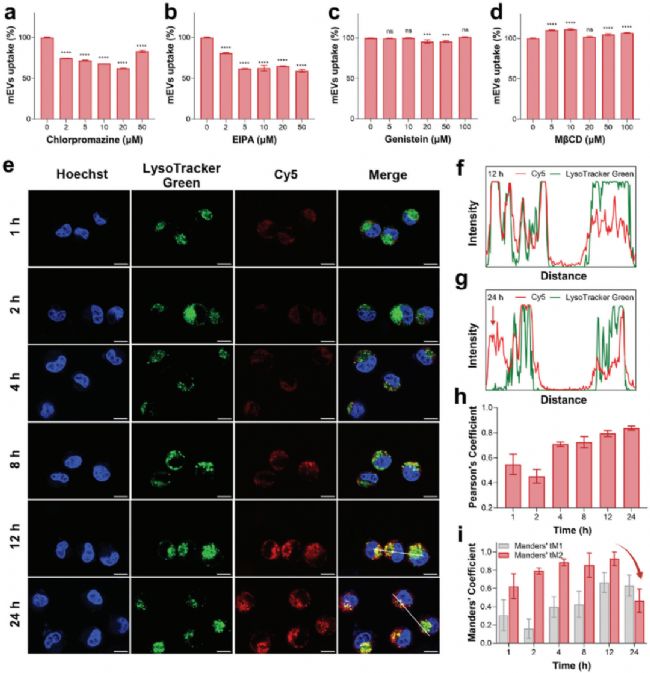
研究者將 mEVs-Cy5 與 MCF-7 細胞共同孵育,通過流式細胞術(FCM)檢測發現,隨著孵育時間的延長,細胞的熒光強度在 8 小時達到峰值,隨后略有下降,表明 mEVs 攝取存在飽和狀態(圖4b, c)。此外,研究發現細胞的熒光強度與 Cy5 標記密度呈嚴格的線性關系,這充分說明標記過程并未影響 mEVs 的細胞攝取能力(圖4d)。進一步,通過 NanoFCM 對細胞培養基中 mEVs-Cy5 的濃度變化進行準確定量。結果顯示,與 MCF-7 細胞共孵育后,mEVs-Cy5 的濃度顯著降低,證實細胞成功攝取了 mEVs。經基于濃度變化的計算,每個 MCF-7 細胞平均攝取了約 2938 個 mEVs(圖4h)。
通過抑制劑實驗,研究者進一步分析了 mEVs 在細胞內的轉運路徑,并確定其進入細胞主要通過網格蛋白介導的內吞和巨胞飲作用。此外,通過共聚焦激光熒光顯微鏡觀察,發現 mEVs 最初與溶酶體共定位,但 24 小時后部分 mEVs 成功從溶酶體中逃逸(圖5a-g)。上述發現揭示了 mEVs 在細胞內的轉運特征,為其在細胞質中釋放藥物提供了潛在的作用機制和理論依據。
04 藥物遞送和細胞毒性
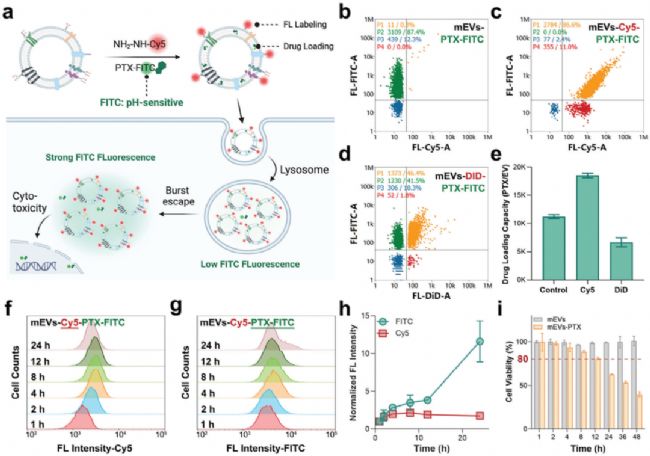
為了評估 mEVs 作為藥物遞送載體的潛力,研究者將化療藥物紫杉醇(FITC標記,PTX-FITC)裝載至 mEVs 中,并利用新方法實現雙重標記(Cy5標記mEVs,FITC標記藥物)。通過 NanoFCM 分析,發現約 90% 的 mEVs 成功裝載了 PTX-FITC,進一步的共標記實驗表明,裝載了 PTX 藥物的 mEVs 均標記上了 Cy5,雙陽性比例高達 86.6%。相比之下,傳統親脂性染料 DiD 標記顯著減弱了 mEVs 載藥的能力(圖6b-d)。綜上結果表明,mEVs 具備高效裝載藥物的能力,且聚糖錨定標記不影響 mEVs 的載藥能力。
進一步通過 FCM 實時跟蹤細胞攝取過程,結果顯示,細胞內 Cy5 熒光強度在 8 小時達到峰值,而 FITC 熒光強度在 24 小時后顯著增加。此外,利用 FITC 的 pH 敏感熒光特性,研究者觀察到其熒光信號的變化,證實了 mEVs 能夠逃離溶酶體,并將攜帶的藥物以“爆發式”方式釋放至細胞質中(圖6f-h)。癌細胞毒性實驗也顯示,mEVs-PTX-FITC 在作用 24 小時后顯示出顯著的細胞毒性(圖6i),這一結果證明,mEVs 能夠有效地將藥物遞送到細胞內,并發揮治療效果。
總 結
本研究通過開發基于聚糖錨定的熒光標記技術,克服傳統標記方法的局限性,實現了對 mEVs 的高效、穩定標記。此種標記方法不會損害 mEVs 的完整性或攝取行為,也不會誘導囊泡聚集或染料泄漏,其綜合表現顯著優于傳統的膜染料。已有數據表明,基于聚糖錨定的熒光標記技術具有廣泛的適用性,已在多種來源的 EVs 中成功實現。此外,本研究還評估了 mEVs 作為藥物遞送載體的潛力,裝載了紫杉醇的 mEVs 在癌細胞內展現出顯著的殺傷作用,有力證實了其作為藥物遞送載體的潛力。該技術不僅為 EVs 的細胞攝取和藥物遞送機制提供了重要理論依據,還為基于 EVs 的靶向藥物遞送進一步研究和應用鋪平了道路。





