細胞外囊泡在液體活檢中臨床應用共識解讀,EVs從實驗室到病床邊的跨越
細胞外囊泡(EVs)是細胞分泌的納米級膜囊泡,攜帶 DNA、RNA、蛋白質等生物信息,廣泛存在于血液、唾液、尿液、淚液等體液中。EVs 憑借獨特的生物學特性,在細胞間通訊中扮演關鍵角色,參與免疫調節、細胞增殖、分化等重要生理過程,同時與多種疾病的發生、發展密切相關,在疾病的早期診斷、治療監測、靶向治療以及預后評估等方面展現出巨大的應用潛力,因此成為生命科學和醫學領域的研究熱點。
盡管 EVs 相關的科學研究取得了顯著進展,但目前行業的發展仍面臨諸多挑戰。在基礎研究方面,雖然已經認識到 EVs 具有重要的生物學功能,但尚未明確其具體的形成機制、分類標準以及不同亞型 EVs 的功能差異等。在技術層面,缺乏統一、標準化的樣本采集、分離、鑒定和分析方法,這使得不同研究之間的結果難以比較和整合,限制了 EVs 研究成果的臨床轉化。此外,EVs 作為疾病生物標志物的篩選和驗證過程復雜,面臨著靈敏度和特異性不足等問題。
為了應對這些挑戰,推動 EVs 研究從基礎走向臨床應用,中國抗癌協會腫瘤標志物專業委員會外泌體與微囊泡學組(CSEMV)的專家們在 2018 年發布的《外泌體轉化研究與臨床實踐的中國專家共識》基礎上,結合近年來 EVs 領域的最新研究成果和發展趨勢,重新梳理和總結相關知識,于近期發布了《細胞外囊泡在液體活檢中的臨床應用共識》。這是全球首個系統性規范 EVs 從分離、表征到臨床應用全流程的指南,推動其從實驗室向臨床的跨越,賦能精準醫療,助力構建“早篩-診斷-治療”閉環!

納米流式檢測技術(nFCM)被共識列為EV單顆粒分析的金標準(圖1),其技術意義遠超傳統方法:

圖1. EV單顆粒分析技術
01 高靈敏度檢測
突破光學檢測極限,可通過散射直接檢測到直徑低至 40 nm 的 EVs,大大提高了對微小囊泡的檢測能力,這對于研究低豐度 EVs 或檢測疾病早期的微弱變化具有重要意義,有助于發現更多潛在的生物標志物,提高疾病診斷的準確性和早期檢出率。
02 多參數表征
可以同時對 EVs 的粒徑、濃度、表面及腔內蛋白甚至核酸進行快速分析,單次檢測即可獲取更全面的信息。通過精確測量粒徑分布和濃度,能夠更準確地評估 EVs 的質量和數量變化;對蛋白和核酸的分析則有助于區分不同亞型的 EVs,深入了解其功能和來源,為研究 EVs 在細胞間通訊和疾病發生發展中的作用提供關鍵數據支持。
03 臨床落地
nFCM 已應用于結直腸癌、前列腺癌、肺癌、卵巢癌、鼻咽癌等 EV 標志物研究,共識的背書將推動其臨床落地。
-
早期診斷:鼻咽癌血漿 EVs 的 5 種蛋白標志物診斷準確性提升至 96.3%;(參見往期文章:廈大團隊揭秘如何通過 EVs 區分癌癥和炎癥)
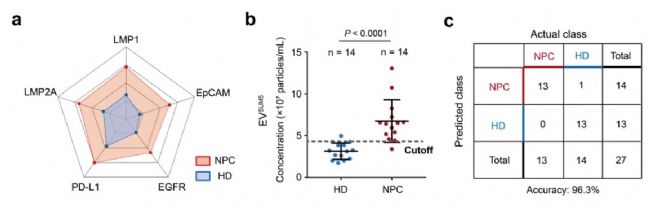
圖2. 鼻咽癌早期診斷
-
動態監測:新冠感染者血漿 EVs Spike 和 CD31 蛋白的動態變化預測免疫治療響應;(參見往期文章:熱點 | 血清外泌體及時響應 COVID-19 感染)
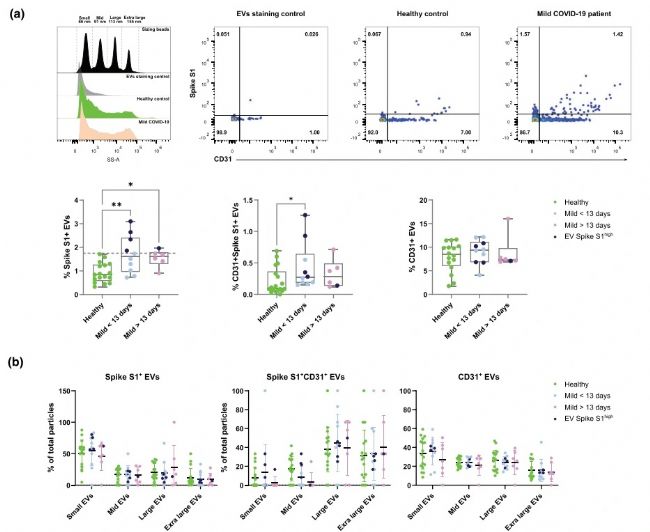
圖3. 動態監測新冠感染者外泌體 Spike 和 CD31 蛋白圖3. 動態監測新冠感染者外泌體 Spike 和 CD31 蛋白
-
預后評估:結直腸癌患者術后血漿 EVs CD147 水平下降。
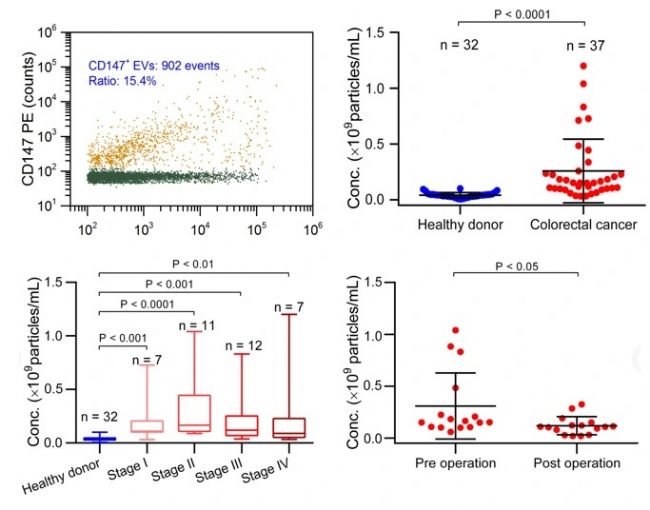
圖4. 結直腸癌術后監測
未來展望
隨著該共識和納米流式檢測技術的應用,我們有理由相信液體活檢將邁入“單囊泡級精準診療”時代!基于共識制定的標準化工作流程和 nFCM 的單囊泡檢測能力,能精準識別更多疾病相關的 EVs 生物標志物,實現癌癥、神經系統疾病等多種疾病的早期診斷和病情的動態監測,提升疾病診斷的準確率。同時,在治療方面,EVs 作為藥物載體的潛力將被充分挖掘,結合 nFCM 對藥物載體質量的把控,推動個性化治療方案的發展,在提高治療效果的同時降低副作用。此外,將促進科研機構、高校和企業間的深度合作,形成完整的 EVs 研究產業鏈,加速相關科研成果轉化為實際臨床應用。未來,EVs 研究與應用將更加規范、高效,為人類健康事業提供更多創新解決方案,帶來更多福祉。
參考文獻:
1. Dong X, Lin Y, Li K, et al. Consensus statement on extracellular vesicles in liquid biopsy for advancing laboratory medicine. Clin Chem Lab Med. 2024; 63(3):465-482. Published 2024 Jun 19. doi:10.1515/cclm-2024-0188
2. Hu Y, Tian Y, Di H, et al. Noninvasive Diagnosis of Nasopharyngeal Carcinoma Based on Phenotypic Profiling of Viral and Tumor Markers on Plasma Extracellular Vesicles. Anal Chem. 2022; 94(27):9740-9749. doi:10.1021/acs.analchem.2c01311
3. Yim KHW, Borgoni S, Chahwan R. Serum extracellular vesicles profiling is associated with COVID-19 progression and immune responses. J Extracell Biol. 2022; 1(4):e37. doi:10.1002/jex2.37
4. Tian Y, Ma L, Gong M, et al. Protein Profiling and Sizing of Extracellular Vesicles from Colorectal Cancer Patients via Flow Cytometry. ACS Nano. 2018; 12(1):671-680. doi:10.1021/acsnano.7b07782
5. Jin Li, Yingying Li, Qin Li, Lu Sun, et al. An Aptamer-Based Nanoflow Cytometry Method for the Molecular Detection and Classification of Ovarian Cancers through Profiling of Tumor Markers on Small Extracellular Vesicles[J]. Angewandte Chemie,https://doi.org/10.1002/anie.202314262





