使用Streptozotocin構建大小鼠糖尿病模型的機制及其應用案例
動物模型是研究糖尿病病理機制、探尋其抑制策略的重要實驗工具。Streptozotocin(STZ,鏈脲佐菌素,AbMole,M2082)是當前1型及2型糖尿病動物造模的首選工具化合物之一,被廣泛用于糖尿病研究。AbMole為全球科研客戶提供高純度、高生物活性的抑制劑、細胞因子、人源單抗、天然產物、熒光染料、多肽、靶點蛋白、化合物庫、抗生素等科研試劑,全球大量文獻專利引用。
一、STZ誘導大鼠糖尿病的機制
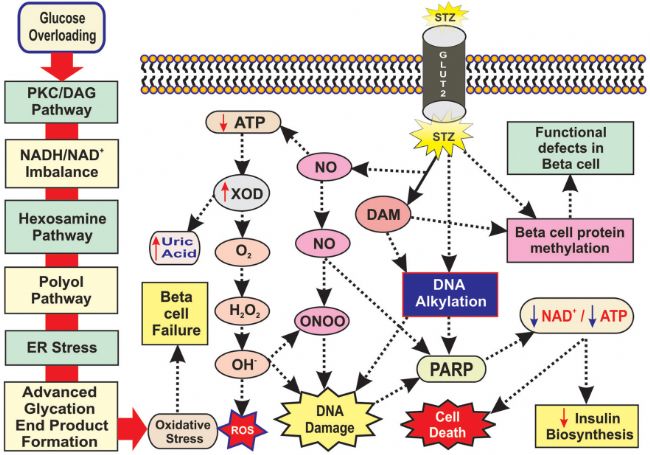
動物糖尿病模型的特征是血糖水平升高并伴有其他器官功能障礙或并發癥,動物1型糖尿病是由β細胞過度凋亡引起的,而2型糖尿病主要是由胰島素抵抗增加造成的。鏈脲佐菌素(STZ,AbMole,M2082)最初是由土壤微生物鏈霉菌中分離而來,并顯示出廣譜抗生素活性[1]。在結構上,它類似于2-脫氧葡萄糖,但在C2位置被N-甲基-N基團取代,一端連接著甲基,另一端連接著葡萄糖分子。Streptozotocin可經過GLUT2(葡萄糖轉運蛋白 2)在胰腺β細胞中積累,Streptozotocin可在胞內轉變為重氮甲烷(DAM,一種烷化劑)[1],引起 DNA 甲基化并導致β細胞功能障礙。除此之外,STZ 還通過多種機制誘導糖尿病,例如STZ本身也是NO供體,NO的過量產生也是 STZ誘導動物糖尿病的重要機理之一,NO可以抑制DNA保護酶(如Aconitase),可間接加劇DNA損傷[2];Streptozotocin還會在β細胞內產生尿酸,在此過程中會產生各種活性氧(ROS)、活性氮(RNS)并引起β細胞內的氧化應激和死亡[3]。Streptozotocin還能夠耗竭煙酰胺腺嘌呤二核苷酸(NAD)、誘導ATP 水平的降低以及胰島素合成和分泌的連續減少[2, 4]、抑制O-GlcNAcase(OGA)的活性進而導致內質網應激和β細胞凋亡[4]。
1.STZ的溶解
Streptozotocin(STZ,鏈脲佐菌素,AbMole,M2082)是可溶于水、醇和酮的親水性化合物。STZ 在4.5的酸性 pH 值下保持穩定,一旦pH值超過4.5會導致其降解。因此,STZ應該用偏酸性的緩沖液進行配制,例如0.1 M 冰冷的檸檬酸鹽緩沖液(pH 4.5)[6]。STZ的配制還應該嚴格遵循現配現用的原則,新鮮配制的STZ溶液應在15-20分鐘內完成注射,以免降解。如果在2-8℃下避光儲存1周,每天都會減少一定比例的STZ[6]。在一項以小鼠為模型的實驗中,新鮮制備的STZ溶液誘導的β細胞損傷明顯比經過保存的STZ組更高[5]。
2.實驗動物的選擇
Streptozotocin(STZ,鏈脲佐菌素,AbMole,M2082)誘導動物糖尿病模型的效果因物種、性別和動物年齡而有所差異。已有大量文獻通過STZ成功構建了小鼠、大鼠、豚鼠、倉鼠、兔子的糖尿病模型[7]。上述嚙齒動物可表達GLUT2,它特異性地將STZ攝取到β細胞中并加強STZ的糖尿病誘導作用。由于體積小、易于處理和成本效益高,Streptozotocin誘導糖尿病中最常用到的模式動物是小鼠和大鼠。對小鼠多次施用低劑量的STZ會導致胰島損傷、炎癥過程增加和β細胞活性喪失,并會導致實驗鼠的胰島素缺乏和高血糖癥,即1型糖尿病。STZ在CD-1和C57BL/6小鼠模型更容易造模成功;對于大鼠而言,比較適合的種屬是Sprague Dawley(SD)、Wistar和Sherman大鼠,其中SD大鼠最為常用。在STZ誘導的糖尿病模型中,雄性嚙齒動物比雌性更容易造模成功,這可能是由于性別之間的荷爾蒙差異[7]。值得注意的是,8-10周齡的小鼠和大鼠對 STZ 的敏感性要遠遠高于老年動物[6]。
3.STZ的處理劑量
在較低劑量下,Streptozotocin(STZ,鏈脲佐菌素,AbMole,M2082)可能不會引起所需的糖尿病誘導,但在高劑量下,它又可能導致動物死亡。因此,應根據個體動物的體重優化STZ的劑量,以便于成功誘導糖尿病模型,且又不會造成實驗動物的死亡。另外一方面,要建立穩定的糖尿病模型,還應給實驗動物制定合適的飲食計劃,例如在STZ注射前,小鼠應禁食4小時,大鼠禁食6-8小時。胃部和腸道的強酸性環境限制了STZ的經口給藥,因此一般多采用腹腔注射或靜脈注射。以大鼠為例,單次腹腔注射STZ,劑量為60 mg/kg,,在2-4天內大鼠表現出1型糖尿病指標,證實造模成功[6]。一般而言,大鼠的STZ使用范圍在25-100 mg/kg之間,具體的濃度實驗人員應結合鼠齡、體重等進行調整[8]。
2型糖尿病因涉及胰島素抵抗,往往在造模時還要結合高脂飲食。例如,高能量飲食 (HED;58% 脂肪、25% 蛋白質和 17% 碳水化合物) 的大鼠和小鼠會導致胰島素抵抗,此時再進一步給予低劑量Streptozotocin(STZ,鏈脲佐菌素,AbMole,M2082) (大鼠 35 mg/kg,小鼠 150 mg/kg)即可誘導動物產生2型糖尿病[8]。2014年,AbMole的兩款抑制劑分別被西班牙國家心血管研究中心和美國哥倫比亞大學用于動物體內實驗,相關科研成果發表于頂刊 Nature 和 Nature Medicine。
三、范例詳解
1. Sci Adv. 2020 Jul 10;6(28):eaba7260.
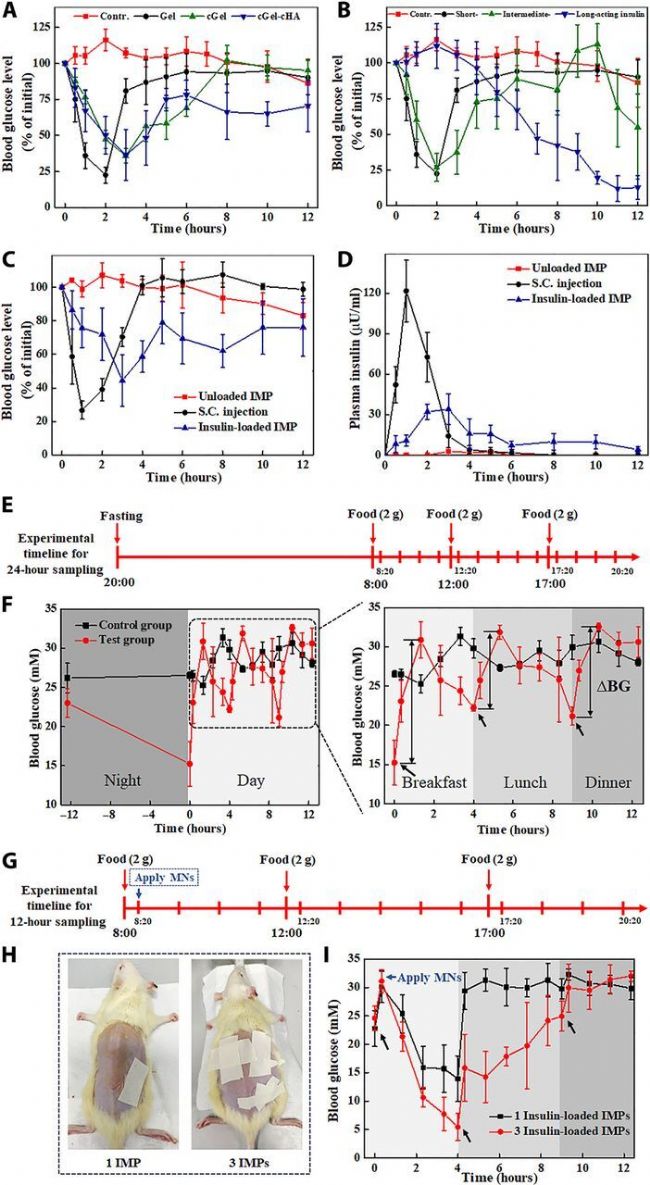
北京化工大學的實驗人員在上述文章中究了一種集成的微針貼片(Integrated Microneedle Patch, IMP),該貼片能夠模擬生理性的胰島素分泌模式,用于控制糖尿病動物模型的餐后血糖波動。文章詳細描述了這種微針貼片的設計、制備、體外和體內實驗驗證,以及其在糖尿病研究中的潛在應用。由AbMole提供的Streptozotocin(STZ,鏈脲佐菌素,M2082) 在上述文章中用于誘導糖尿病大鼠模型[10]。
2.Chemical Engineering Joumnal 497(2024)154522
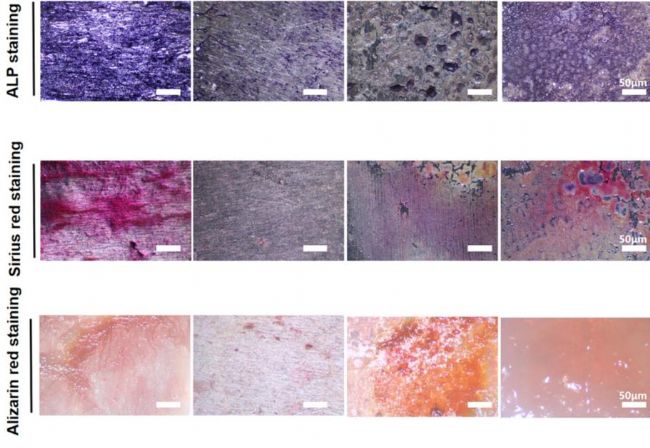
重慶醫科大學第一附屬醫院的實驗人員在上述研究中,設計了一種負載鍶(Sr)的硫辛酸涂層,它可以與Ti植入物(Ti-Ta@Sr)之間形成牢固結合。該涂層有效地消除了高糖環境中產生的過量活性氧,并可恢復高糖條件下成骨細胞的成骨能力和增殖能力。相關實驗人員使用AbMole提供的Streptozotocin(STZ,鏈脲佐菌素,M2082) 成功構建了糖尿病大鼠模型[11]。
3.Bioengineered. 2021 Dec;12(1):5491-5503.
中南大學湘雅醫院、海南醫科大學第一附屬醫院的科研人員在上述論文中研究S14G-humanin(HNG)對鏈脲佐菌素(STZ)誘導的糖尿病小鼠心臟功能障礙的保護作用。研究發現,HNG能夠減輕STZ誘導的心肌肥大,顯著改善心臟功能,并降低心肌損傷指標的水平,包括肌酸激酶-MB(CK-MB)、天門冬氨酸氨基轉移酶(AST)、乳酸脫氫酶(LDH)以及心臟和血漿中的腫瘤壞死因子-α(TNF-α)和白細胞介素-6(IL-6)水平。此外,HNG還能抑制NF-κB信號通路的激活。AbMole的Streptozotocin(STZ,鏈脲佐菌素,M2082)在這篇文章中作為一種誘導劑,用于建立糖尿病小鼠模型。通過STZ誘導糖尿病后,小鼠出現了高血糖、心肌肥大、心臟功能障礙等糖尿病并發癥的特征[12]。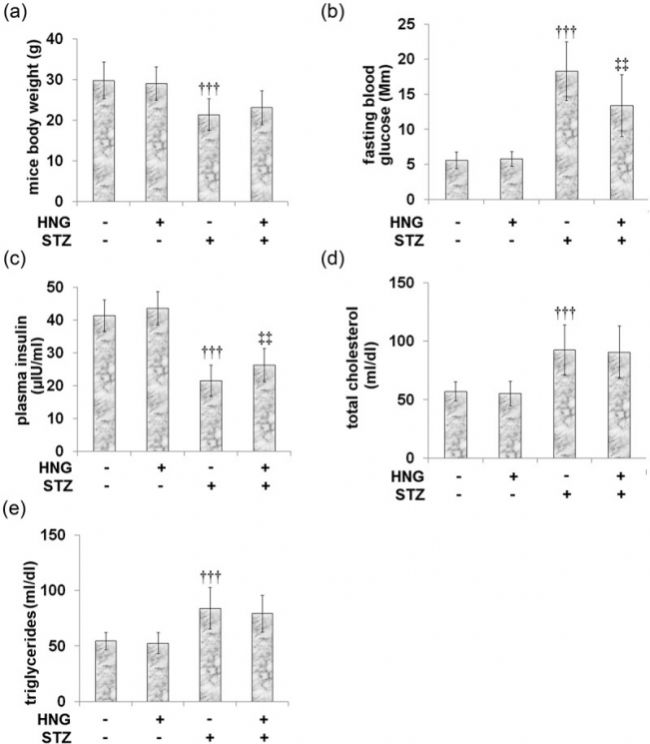
參考文獻
[1] F. Reusser, Mode of action of streptozotocin, Journal of bacteriology 105(2) (1971) 580-8.
[2] C. O. Eleazu, K. C. Eleazu, S. Chukwuma, et al., Review of the mechanism of cell death resulting from streptozotocin challenge in experimental animals, its practical use and potential risk to humans, Journal of Diabetes and Metabolic Disorders 12(1) (2013).
[3] Haider Raza, Subbuswamy K. Prabu, Annie John, et al., Impaired Mitochondrial Respiratory Functions and Oxidative Stress in Streptozotocin-Induced Diabetic Rats, International journal of molecular sciences, 2011, pp. 3133-3147.
[4] T. Szkudelski, The mechanism of alloxan and streptozotocin action in B cells of the rat pancreas, Physiological research 50(6) (2001) 537-46.
[5] Sameer N. Goyal, Navya M. Reddy, Kalpesh R. Patil, et al., Challenges and issues with streptozotocin-induced diabetes – A clinically relevant animal model to understand the diabetes pathogenesis and evaluate therapeutics, Chemico-Biological Interactions 244 (2016) 49-63.
[6] A. F. Bleasel, L. C. J. Yong, Streptozotocin induced diabetic nephropathy and renal tumors in the rat, Experientia 38(1) (1982) 129-130.
[7] S. Kumar, R. Singh, N. Vasudeva, et al., Acute and chronic animal models for the evaluation of anti-diabetic agents, Cardiovascular diabetology 11 (2012) 9.
[8] M. A. Abeeleh, Z. B. Ismail, K. R. Alzaben, et al., Induction of diabetes mellitus in rats using intraperitoneal streptozotocin: A comparison between 2 strains of rats, European Journal of Scientific Research 32(3) (2009) 398-402.
[9] A. Ghasemi, S. Jeddi, Streptozotocin as a tool for induction of rat models of diabetes: a practical guide, EXCLI journal 22 (2023) 274-294.
[10] B. Z. Chen, L. Q. Zhang, Y. Y. Xia, et al., A basal-bolus insulin regimen integrated microneedle patch for intraday postprandial glucose control, Science advances 6(28) (2020) eaba7260.
[11] Kai Li, Wenbo Geng, Weikang Zhao, et al., Design and development of titanium-coated implants with advanced antioxidant properties for enhanced regenerative repair of diabetic bone, Chemical Engineering Journal 497 (2024) 154522.
[12] X. Chen, C. Yun, H. Zheng, et al., The protective effects of S14G-humanin (HNG) against streptozotocin (STZ)-induced cardiac dysfunction, Bioengineered 12(1) (2021) 5491-5503.
一、STZ誘導大鼠糖尿病的機制
動物糖尿病模型的特征是血糖水平升高并伴有其他器官功能障礙或并發癥,動物1型糖尿病是由β細胞過度凋亡引起的,而2型糖尿病主要是由胰島素抵抗增加造成的。鏈脲佐菌素(STZ,AbMole,M2082)最初是由土壤微生物鏈霉菌中分離而來,并顯示出廣譜抗生素活性[1]。在結構上,它類似于2-脫氧葡萄糖,但在C2位置被N-甲基-N基團取代,一端連接著甲基,另一端連接著葡萄糖分子。Streptozotocin可經過GLUT2(葡萄糖轉運蛋白 2)在胰腺β細胞中積累,Streptozotocin可在胞內轉變為重氮甲烷(DAM,一種烷化劑)[1],引起 DNA 甲基化并導致β細胞功能障礙。除此之外,STZ 還通過多種機制誘導糖尿病,例如STZ本身也是NO供體,NO的過量產生也是 STZ誘導動物糖尿病的重要機理之一,NO可以抑制DNA保護酶(如Aconitase),可間接加劇DNA損傷[2];Streptozotocin還會在β細胞內產生尿酸,在此過程中會產生各種活性氧(ROS)、活性氮(RNS)并引起β細胞內的氧化應激和死亡[3]。Streptozotocin還能夠耗竭煙酰胺腺嘌呤二核苷酸(NAD)、誘導ATP 水平的降低以及胰島素合成和分泌的連續減少[2, 4]、抑制O-GlcNAcase(OGA)的活性進而導致內質網應激和β細胞凋亡[4]。

圖 1. Streptozotocin糖尿病造模機理[5]
二、STZ的研究應用1.STZ的溶解
Streptozotocin(STZ,鏈脲佐菌素,AbMole,M2082)是可溶于水、醇和酮的親水性化合物。STZ 在4.5的酸性 pH 值下保持穩定,一旦pH值超過4.5會導致其降解。因此,STZ應該用偏酸性的緩沖液進行配制,例如0.1 M 冰冷的檸檬酸鹽緩沖液(pH 4.5)[6]。STZ的配制還應該嚴格遵循現配現用的原則,新鮮配制的STZ溶液應在15-20分鐘內完成注射,以免降解。如果在2-8℃下避光儲存1周,每天都會減少一定比例的STZ[6]。在一項以小鼠為模型的實驗中,新鮮制備的STZ溶液誘導的β細胞損傷明顯比經過保存的STZ組更高[5]。
2.實驗動物的選擇
Streptozotocin(STZ,鏈脲佐菌素,AbMole,M2082)誘導動物糖尿病模型的效果因物種、性別和動物年齡而有所差異。已有大量文獻通過STZ成功構建了小鼠、大鼠、豚鼠、倉鼠、兔子的糖尿病模型[7]。上述嚙齒動物可表達GLUT2,它特異性地將STZ攝取到β細胞中并加強STZ的糖尿病誘導作用。由于體積小、易于處理和成本效益高,Streptozotocin誘導糖尿病中最常用到的模式動物是小鼠和大鼠。對小鼠多次施用低劑量的STZ會導致胰島損傷、炎癥過程增加和β細胞活性喪失,并會導致實驗鼠的胰島素缺乏和高血糖癥,即1型糖尿病。STZ在CD-1和C57BL/6小鼠模型更容易造模成功;對于大鼠而言,比較適合的種屬是Sprague Dawley(SD)、Wistar和Sherman大鼠,其中SD大鼠最為常用。在STZ誘導的糖尿病模型中,雄性嚙齒動物比雌性更容易造模成功,這可能是由于性別之間的荷爾蒙差異[7]。值得注意的是,8-10周齡的小鼠和大鼠對 STZ 的敏感性要遠遠高于老年動物[6]。
3.STZ的處理劑量
在較低劑量下,Streptozotocin(STZ,鏈脲佐菌素,AbMole,M2082)可能不會引起所需的糖尿病誘導,但在高劑量下,它又可能導致動物死亡。因此,應根據個體動物的體重優化STZ的劑量,以便于成功誘導糖尿病模型,且又不會造成實驗動物的死亡。另外一方面,要建立穩定的糖尿病模型,還應給實驗動物制定合適的飲食計劃,例如在STZ注射前,小鼠應禁食4小時,大鼠禁食6-8小時。胃部和腸道的強酸性環境限制了STZ的經口給藥,因此一般多采用腹腔注射或靜脈注射。以大鼠為例,單次腹腔注射STZ,劑量為60 mg/kg,,在2-4天內大鼠表現出1型糖尿病指標,證實造模成功[6]。一般而言,大鼠的STZ使用范圍在25-100 mg/kg之間,具體的濃度實驗人員應結合鼠齡、體重等進行調整[8]。
2型糖尿病因涉及胰島素抵抗,往往在造模時還要結合高脂飲食。例如,高能量飲食 (HED;58% 脂肪、25% 蛋白質和 17% 碳水化合物) 的大鼠和小鼠會導致胰島素抵抗,此時再進一步給予低劑量Streptozotocin(STZ,鏈脲佐菌素,AbMole,M2082) (大鼠 35 mg/kg,小鼠 150 mg/kg)即可誘導動物產生2型糖尿病[8]。2014年,AbMole的兩款抑制劑分別被西班牙國家心血管研究中心和美國哥倫比亞大學用于動物體內實驗,相關科研成果發表于頂刊 Nature 和 Nature Medicine。

圖 2. 鏈脲佐菌素 (STZ) 被用于構建糖尿病大鼠模型的常用濃度[9]
三、范例詳解
1. Sci Adv. 2020 Jul 10;6(28):eaba7260.
北京化工大學的實驗人員在上述文章中究了一種集成的微針貼片(Integrated Microneedle Patch, IMP),該貼片能夠模擬生理性的胰島素分泌模式,用于控制糖尿病動物模型的餐后血糖波動。文章詳細描述了這種微針貼片的設計、制備、體外和體內實驗驗證,以及其在糖尿病研究中的潛在應用。由AbMole提供的Streptozotocin(STZ,鏈脲佐菌素,M2082) 在上述文章中用于誘導糖尿病大鼠模型[10]。

圖 3. . In vivo studies of the fabricated MNs for diabetes treatment[10]
2.Chemical Engineering Joumnal 497(2024)154522
重慶醫科大學第一附屬醫院的實驗人員在上述研究中,設計了一種負載鍶(Sr)的硫辛酸涂層,它可以與Ti植入物(Ti-Ta@Sr)之間形成牢固結合。該涂層有效地消除了高糖環境中產生的過量活性氧,并可恢復高糖條件下成骨細胞的成骨能力和增殖能力。相關實驗人員使用AbMole提供的Streptozotocin(STZ,鏈脲佐菌素,M2082) 成功構建了糖尿病大鼠模型[11]。

圖 4. Cell osteogenic differentiation of different Ti-based samples[11]
3.Bioengineered. 2021 Dec;12(1):5491-5503.
中南大學湘雅醫院、海南醫科大學第一附屬醫院的科研人員在上述論文中研究S14G-humanin(HNG)對鏈脲佐菌素(STZ)誘導的糖尿病小鼠心臟功能障礙的保護作用。研究發現,HNG能夠減輕STZ誘導的心肌肥大,顯著改善心臟功能,并降低心肌損傷指標的水平,包括肌酸激酶-MB(CK-MB)、天門冬氨酸氨基轉移酶(AST)、乳酸脫氫酶(LDH)以及心臟和血漿中的腫瘤壞死因子-α(TNF-α)和白細胞介素-6(IL-6)水平。此外,HNG還能抑制NF-κB信號通路的激活。AbMole的Streptozotocin(STZ,鏈脲佐菌素,M2082)在這篇文章中作為一種誘導劑,用于建立糖尿病小鼠模型。通過STZ誘導糖尿病后,小鼠出現了高血糖、心肌肥大、心臟功能障礙等糖尿病并發癥的特征[12]。

圖 5. Protective effects of S14G-humanin in basic parameters of diabetic mice[12]
參考文獻
[1] F. Reusser, Mode of action of streptozotocin, Journal of bacteriology 105(2) (1971) 580-8.
[2] C. O. Eleazu, K. C. Eleazu, S. Chukwuma, et al., Review of the mechanism of cell death resulting from streptozotocin challenge in experimental animals, its practical use and potential risk to humans, Journal of Diabetes and Metabolic Disorders 12(1) (2013).
[3] Haider Raza, Subbuswamy K. Prabu, Annie John, et al., Impaired Mitochondrial Respiratory Functions and Oxidative Stress in Streptozotocin-Induced Diabetic Rats, International journal of molecular sciences, 2011, pp. 3133-3147.
[4] T. Szkudelski, The mechanism of alloxan and streptozotocin action in B cells of the rat pancreas, Physiological research 50(6) (2001) 537-46.
[5] Sameer N. Goyal, Navya M. Reddy, Kalpesh R. Patil, et al., Challenges and issues with streptozotocin-induced diabetes – A clinically relevant animal model to understand the diabetes pathogenesis and evaluate therapeutics, Chemico-Biological Interactions 244 (2016) 49-63.
[6] A. F. Bleasel, L. C. J. Yong, Streptozotocin induced diabetic nephropathy and renal tumors in the rat, Experientia 38(1) (1982) 129-130.
[7] S. Kumar, R. Singh, N. Vasudeva, et al., Acute and chronic animal models for the evaluation of anti-diabetic agents, Cardiovascular diabetology 11 (2012) 9.
[8] M. A. Abeeleh, Z. B. Ismail, K. R. Alzaben, et al., Induction of diabetes mellitus in rats using intraperitoneal streptozotocin: A comparison between 2 strains of rats, European Journal of Scientific Research 32(3) (2009) 398-402.
[9] A. Ghasemi, S. Jeddi, Streptozotocin as a tool for induction of rat models of diabetes: a practical guide, EXCLI journal 22 (2023) 274-294.
[10] B. Z. Chen, L. Q. Zhang, Y. Y. Xia, et al., A basal-bolus insulin regimen integrated microneedle patch for intraday postprandial glucose control, Science advances 6(28) (2020) eaba7260.
[11] Kai Li, Wenbo Geng, Weikang Zhao, et al., Design and development of titanium-coated implants with advanced antioxidant properties for enhanced regenerative repair of diabetic bone, Chemical Engineering Journal 497 (2024) 154522.
[12] X. Chen, C. Yun, H. Zheng, et al., The protective effects of S14G-humanin (HNG) against streptozotocin (STZ)-induced cardiac dysfunction, Bioengineered 12(1) (2021) 5491-5503.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





