論文解讀:無線EEG與HD-MEA揭示SYNGAP1缺失小鼠的腦電特征
SYNGAP1 缺失如何引發(fā)神經(jīng)發(fā)育障礙(NDD)?SYNGAP1 相關(guān)智力障礙(SRID)患者存在發(fā)育遲滯、智力障礙、運動功能受損和癲癇等癥狀,但其致病機制尚不明確。
2024年,加州大學戴維斯分校醫(yī)學院MIND研究所 Jill Silverman教授團隊在Translational Psychiatry(IF2023=5.8)上發(fā)表了題名為“Hyperexcitability and translational phenotypes in a preclinical mouse model of SYNGAP1-related intellectual disability”的文章。研究以 Syngap1 雜合子小鼠為模型,探究 SYNGAP1 缺失對神經(jīng)元結(jié)構(gòu)與功能、行為表型及電生理活動的影響,旨在明確 SRID 的病理機制,尋找可用于評估靶向治療效果的生物標志物。

研究亮點
1、首次結(jié)合體內(nèi)外電生理研究
通過無線 EEG 發(fā)現(xiàn) Syngap1+/- 小鼠 delta 和 theta 功率升高、 spike trains 增多,首次利用 HD-MEA 證實其原代神經(jīng)元網(wǎng)絡(luò)放電活動增強、爆發(fā)頻率增加且爆發(fā)間隔縮短,橋接了體外神經(jīng)元電生理與體內(nèi)腦電活動。
2、發(fā)現(xiàn)新型轉(zhuǎn)化表型
明確睡眠結(jié)構(gòu)異常(慢波睡眠減少、主動覺醒增加)可作為 SRID 潛在生物標志物,為臨床診斷和治療評估提供新方向。
3、行為表型的系統(tǒng)驗證
通過多種行為測試(開放場、Y 迷宮、新物體識別等)全面證實 Syngap1+/- 小鼠存在多動、認知缺陷及焦慮樣行為減少,為 SRID 病理機制研究提供堅實行為學證據(jù)。
Maxwell HD-MEA
Maxwell HD-MEA的很多特點使得它受到神經(jīng)科學家們及人工智能科學家們的青睞:
⚫ 3265 electrods/mm2的高密度電極
Maxwell MEA芯片上有26400個電極。這樣的密度使其可以記錄2D培養(yǎng)物中幾乎每一個活細胞;而對于3D類器官更為關(guān)鍵,因為類器官與芯片接觸面積通常比較小,如此高的密度提供了足夠的記錄位點獲取大量神經(jīng)元信息。
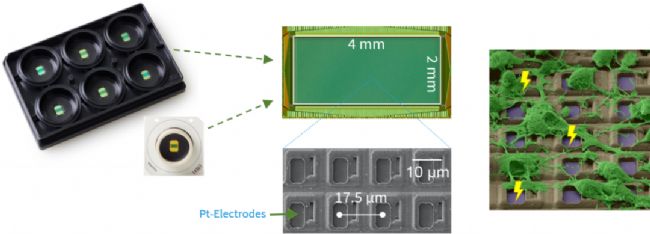
Maxwell MEA 芯片
⚫可放在培養(yǎng)箱內(nèi)進行記錄
這使得在記錄過程中細胞能夠維持良好的生理狀態(tài),支持反復(fù)長期的檢測。
⚫低本底噪音,高信噪比
僅為2.4微伏的本底噪音保證了高質(zhì)量的讀取信號,使得AI系統(tǒng)獲得足夠豐富的輸出信息。
⚫電極可作為刺激電極
在2萬多個電極中每一個電極都可作為刺激電極給出刺激,這在構(gòu)建的AI系統(tǒng)中成為重要的信息輸入的媒介。在此,高電極密度也為這種信息輸入提供了高空間分辨率的特性。
⚫可開放API,實現(xiàn)快速實時反饋系統(tǒng)
Maxwell HD-MEA可開放API,允許其它軟件的操控,靈活地設(shè)計輸入輸出模式,能夠在輸入與輸出間建立實時的反饋。
研究結(jié)果
突變小鼠中SynGAP1蛋白水平降低
研究人員對出生后第42天(PND42)的Syngap1+/−突變小鼠和同窩野生型(WT)對照小鼠的皮層裂解物進行了Western blot分析,使用已驗證的抗體檢測SynGAP1總蛋白表達水平(以GAPDH為內(nèi)參)。Western blot結(jié)果顯示兩條與已知SynGAP1亞型對應(yīng)的條帶,研究者對其中較大的主要亞型條帶進行了定量分析。結(jié)果顯示,雜合突變體Syngap1+/−的SynGAP1蛋白水平降至野生型標準化表達的41%。
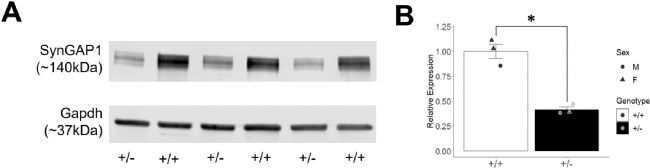
圖1:Syngap1+/-小鼠SynGAP1蛋白表達顯著降低
A PND42的Syngap1+/+和Syngap1+/-小鼠的SynGAP1與Gapdh蛋白表達。Western Blot顯示Syngap1+/-小鼠SynGAP1(140kDa)表達降低。B 經(jīng)Gapdh標準化后的SynGAP1蛋白定量顯示,Syngap1+/-腦組織SynGAP1表達量僅為野生型同窩對照的41%。數(shù)據(jù)采用t檢驗,*P=0.0051(各組n=3)。
突變小鼠的運動增多和認知功能受損
通過行為學實驗系統(tǒng)評估了Syngap1+/−小鼠的運動和認知功能。
在曠場實驗中,突變小鼠表現(xiàn)出顯著的多動癥狀,其水平活動和總活動量在所有時間段均顯著高于野生型,且中心區(qū)域停留時間增加,結(jié)合高架十字迷宮實驗結(jié)果,提示其可能具有焦慮樣行為減少和多動共存的復(fù)雜表型。認知功能測試顯示,在新物體識別任務(wù)中,突變小鼠對新物體的探索偏好降低,表明長期記憶受損;而在Y迷宮測試中,雖然工作記憶的正確率無顯著差異,但其臂間轉(zhuǎn)換次數(shù)顯著增多,再次印證了多動特征。
這些結(jié)果共同表明,Syngap1單倍劑量不足會導(dǎo)致小鼠出現(xiàn)明顯的多動行為和認知功能障礙,其中多動表型在不同行為范式測試中表現(xiàn)一致且顯著,而認知缺陷主要體現(xiàn)在長期記憶方面。
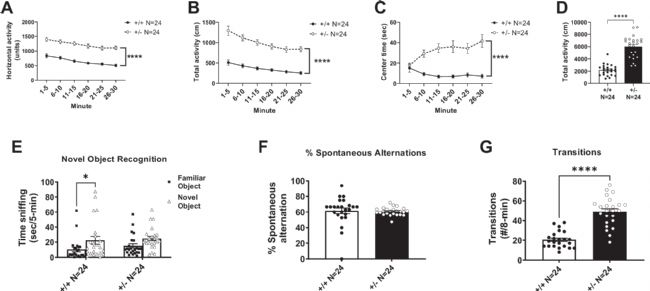
圖2:Syngap1+/-小鼠運動活性增強伴認知障礙
A水平活動、B總活動量和C中心區(qū)域停留時間均顯著增加(重復(fù)測量ANOVA)。D 30分鐘總活動量比較(t檢驗)。E新物體識別測試中突變鼠未表現(xiàn)偏好。F自發(fā)交替任務(wù)正確率無差異。G臂間轉(zhuǎn)換次數(shù)顯著增多(t檢驗)。P<0.05,***P<0.0001。
突變小鼠的體內(nèi)腦電圖改變
通過無線遙測技術(shù)對Syngap1+/-突變小鼠進行了系統(tǒng)的腦電活動和睡眠結(jié)構(gòu)分析。
研究結(jié)果顯示,與野生型小鼠相比,突變小鼠表現(xiàn)出顯著的腦電圖異常:72小時連續(xù)監(jiān)測發(fā)現(xiàn)其絕對功率譜密度(PSD)整體升高,特別是Delta波(0.5-4Hz)和Theta波(5-9Hz)功率顯著增強,同時棘波串數(shù)量和持續(xù)時間明顯增加,這些發(fā)現(xiàn)提示Syngap1單倍劑量不足導(dǎo)致神經(jīng)元網(wǎng)絡(luò)過度興奮。
在睡眠結(jié)構(gòu)方面,突變小鼠表現(xiàn)出明顯的睡眠-覺醒周期紊亂:主動覺醒時間顯著增加,安靜覺醒時間減少,慢波睡眠比例明顯降低,異相睡眠雖未達統(tǒng)計學顯著性但也有減少趨勢。
這些電生理和行為學改變與人類SYNGAP1相關(guān)神經(jīng)發(fā)育障礙患者的臨床特征高度吻合,為理解該基因缺陷導(dǎo)致神經(jīng)系統(tǒng)異常的內(nèi)在機制提供了重要實驗依據(jù)。
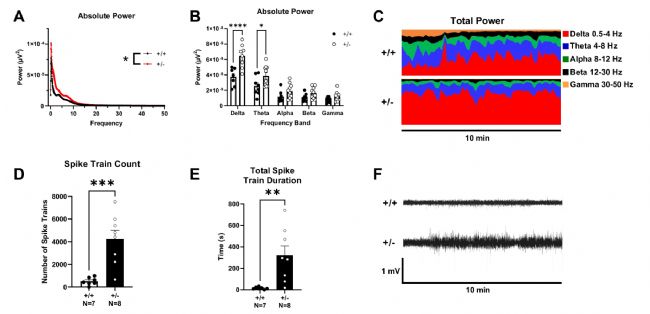
圖3:Syngap1+/-小鼠delta/theta波功率增強
無線遙測EEG顯示:A功率譜密度整體升高;B delta/theta頻段功率顯著增加;C 10分鐘功率分布示delta/theta波增強;D棘波串計數(shù);E棘波串總時長增加;F代表性EEG波形(雙因素ANOVA與t檢驗)。P<0.05,P<0.01,P<0.001,****P<0.0001。
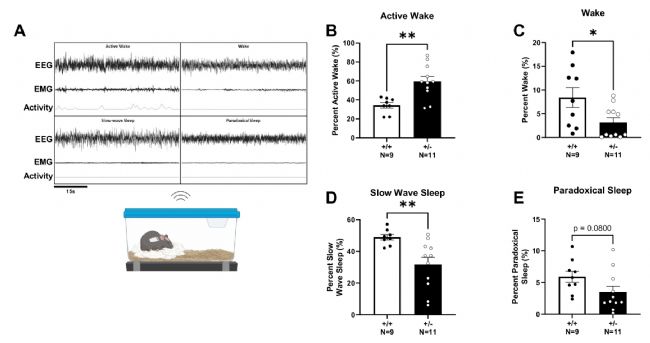
圖4:Syngap1+/-小鼠睡眠特征改變
A無線記錄系統(tǒng)示意圖及四期睡眠特征波形。B主動覺醒期比例增加;C安靜覺醒期減少;D慢波睡眠減少;E異相睡眠有降低趨勢(t檢驗)。*P<0.05,**P<0.01。
突變小鼠原代培養(yǎng)神經(jīng)元電生理活動增強
通過高密度微電極陣列技術(shù)(HD-MEA)系統(tǒng)比較了Syngap1+/-突變小鼠與野生型原代皮層神經(jīng)元的電生理特性。
研究發(fā)現(xiàn)Syngap1單倍劑量不足導(dǎo)致神經(jīng)元網(wǎng)絡(luò)活動顯著增強,表現(xiàn)為:動作電位形態(tài)改變、爆發(fā)式放電活動增多、爆發(fā)間隔縮短等特征性改變。具體而言,突變神經(jīng)元雖然每次爆發(fā)包含的放電次數(shù)減少,但爆發(fā)頻率在培養(yǎng)第21天(DIV21)后持續(xù)增加,爆發(fā)間隔時間從DIV21開始顯著縮短,至DIV29時爆發(fā)持續(xù)時間也明顯延長。
這些電生理異常表明Syngap1缺失導(dǎo)致神經(jīng)元網(wǎng)絡(luò)興奮性增高和同步化活動增強,可能反映了突觸可塑性和神經(jīng)網(wǎng)絡(luò)功能的紊亂。
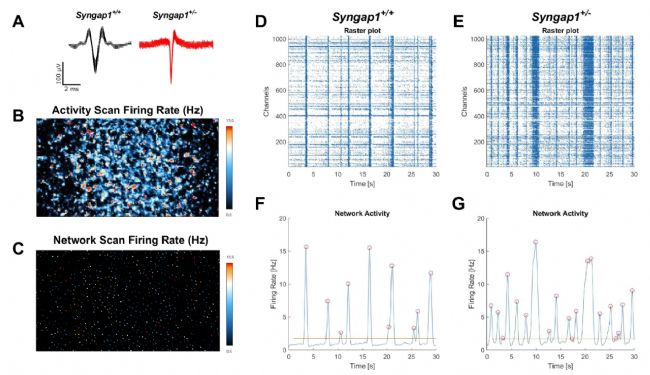
圖5:Syngap1+/-原代神經(jīng)元網(wǎng)絡(luò)放電活動增強
A動作電位波形疊加;B全芯片放電頻率;C網(wǎng)絡(luò)活性掃描電極選擇;D野生型柵格圖;F野生型網(wǎng)絡(luò)活動;E突變型柵格圖;G突變型網(wǎng)絡(luò)活動增強(同步記錄1024個電極)。
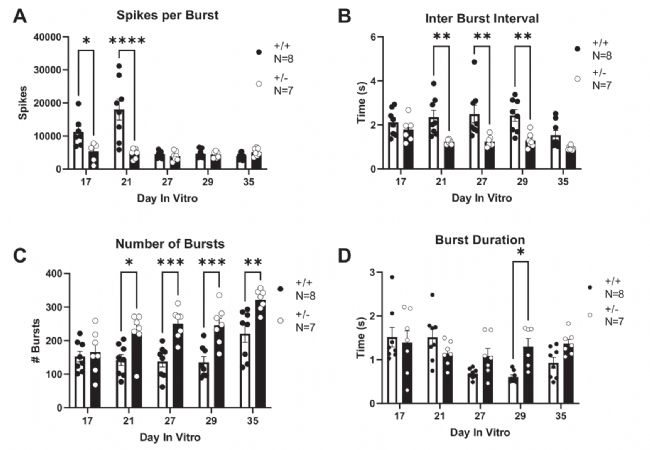
圖6:Syngap1+/-神經(jīng)元爆發(fā)活動增加
A單次爆發(fā)放電次數(shù)減少;B爆發(fā)間隔(IBI)在DIV21/27/29縮短;C DIV21后爆發(fā)次數(shù)持續(xù)增加;D DIV29爆發(fā)時長延長(雙因素ANOVA)。P<0.05,P<0.01,P<0.001,****P<0.0001。
研究總結(jié)
本研究通過整合HD-MEA和無線腦電技術(shù),首次在Syngap1+/-小鼠模型中系統(tǒng)揭示了突觸功能障礙與神經(jīng)發(fā)育障礙的關(guān)聯(lián)。
研究發(fā)現(xiàn),Syngap1單倍劑量不足導(dǎo)致神經(jīng)元網(wǎng)絡(luò)活動增強、睡眠結(jié)構(gòu)紊亂及認知行為異常,并首次在體外和體內(nèi)水平建立了電生理與行為表型的橋梁。
這些發(fā)現(xiàn)為SRID的精準治療提供了關(guān)鍵生物標志物和潛在干預(yù)靶點,推動了從基礎(chǔ)研究到臨床轉(zhuǎn)化的突破。
參考文獻:
Fenton TA, Haouchine OY, Hallam EB, et al. Hyperexcitability and translational phenotypes in a preclinical mouse model of SYNGAP1-related intellectual disability. Transl Psychiatry. 2024 Oct 2;14(1):405. doi: 10.1038/s41398-024-03077-6.





