AAV-RGDLRVS對主動脈內皮細胞的轉染效率如何?
2025年6月3日,空軍軍醫大學基礎醫學部生理與病理生理教研室聯合西安交通大學團隊在Cell Metabolism(IF=27.7)在線發表題為“O-GlcNAcylation-mediated endothelial metabolic memory contributes to cardiac damage via small extracellular vesicles”的研究論文,本研究揭示了一種通過O-GlcNA酰化實現內皮代謝記憶的新機制,并確定了糖尿病EC衍生的小細胞外囊泡(sEVs)的記憶特征會導致心臟損傷。


研究背景
糖尿病(DM)的患病率顯著增加,已成為一個主要的全球公共衛生問題。眾所周知,糖尿病顯著增加了心力衰竭的風險,與缺血性心臟病或其他并發癥的存在無關;另一方面,臨床證據也表明,在心力衰竭患者中,糖尿病是不良預后的關鍵決定因素。盡管治療后血糖恢復正常,但高血糖產生的適應不良特征仍然存在。據推測,血管系統中早期的高血糖可能會被內皮細胞(ECs)記住,從而導致隨后的心血管并發癥。這種現象被稱為“高血糖記憶”或“代謝記憶”,主要用于描述高血糖對血管并發癥的長期負面影響。然而,代謝記憶在糖尿病心肌病或心力衰竭發展中的作用在很大程度上仍不清楚。
研究結果分享
1、代謝記憶產生的sEV miR-15-16上調FoxO1信號傳導
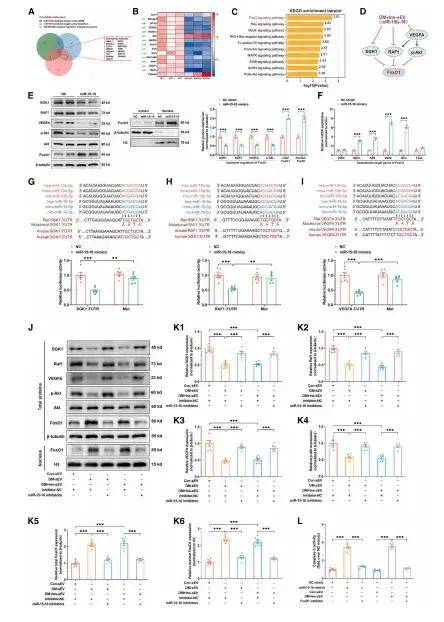
作者通過體內外實驗研究發現在8周的高血糖(HG)應激后,糖尿病來源的循環小細胞外囊泡(sEVs)對心肌細胞產生持續性不利影響,并在健康動物中誘導心臟功能障礙,盡管后續血糖恢復正常。這表明HG誘導的循環sEVs表現出“記憶”特征,可能促使糖尿病患者殘留部分心力衰竭風險。考慮到在糖尿病8周時sEVs產生的不良影響,對從8周糖尿病和非糖尿病對照組大鼠血漿中收集的sEVs進行高通量RNA測序,鑒定發現miR-15b-5p和miR-16-5p是代謝記憶產生的循環sEVs中的作用分子。miR-15b-5p和miR-16-5p被轉錄為miR-15-16,位于同一染色體區域,并且高度保守,考慮到兩者的協同作用,后續使用其模擬物或抑制劑探究了miR-15-16誘導心肌細胞凋亡的分子機制。結果表明,sEVs miR-15-16靶向FoxO1信號通路的一系列上游調節因子,并通過上調心肌細胞中的FoxO1發揮促凋亡作用,進而導致心臟功能障礙。
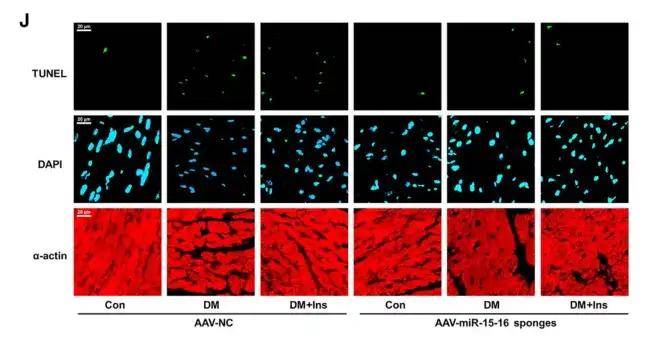
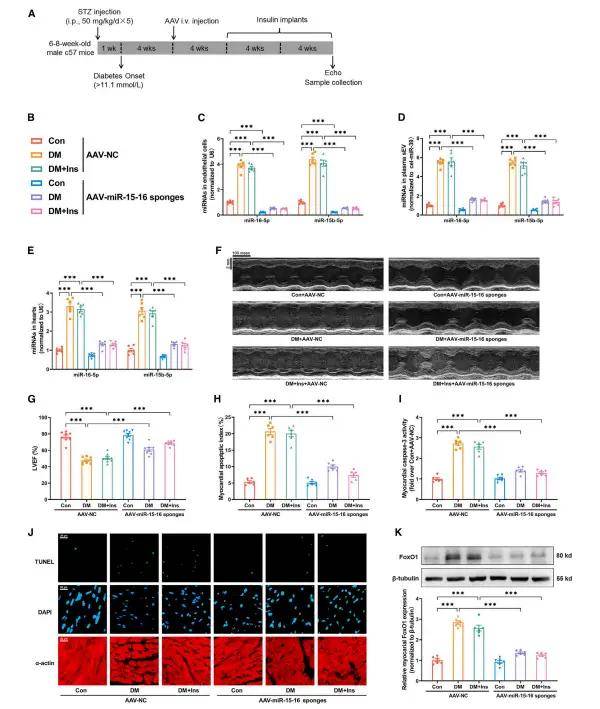
作者進一步研究發現代謝記憶誘導動脈內皮細胞分泌sEV miR-15-16,為了探索內皮miR-15-16在體內代謝記憶誘導的心臟功能障礙中的作用,作者利用AAV9介導miR-15-16海綿遞送給小鼠,實現了EC特異性的miR-15-16敲低。與NC海綿組相比,EC特異性miR-15-16海綿組血漿sEV miR-15-16的表達顯著降低,表明動脈EC是代謝記憶誘導的血漿sEV miR-15-16的主要來源。此外,在DM或DM+Ins(代謝記憶動物模型)組中,EC特異性miR-15-16敲低降低了心肌miR-15-16的表達,改善了心功能,并抑制了心肌細胞凋亡和FoxO1的表達。這些數據表明,內皮細胞分泌的sEV miR-15-16參與了代謝記憶誘導的心臟損傷和功能障礙。
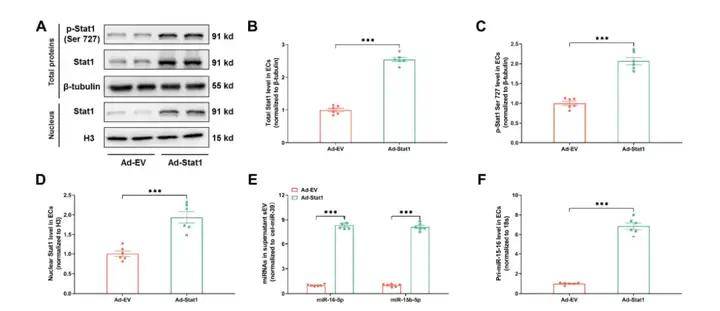
作者進一步探究了代謝記憶促進ECs分泌sEV miR-15-16的機制,發現HG對miR-15-16的作用可能通過誘導蛋白質O-GlcNAc糖基化介導。糖尿病動脈ECs中O-GlcNAc糖基化、CaMK2a活性、CaMK2a-Stat1結合以及Stat1在Ser727位點的磷酸化均顯著升高,即使后期通過胰島素植入實現血糖正常化,這些指標仍顯著升高。利用腺病毒在ECs中過表達Stat1,實驗發現Stat1可以與pri-miR-15-16啟動子結合,以增強EC中sEV miR-15-16的分泌。隨后,作者通過抑制CaMK2a/Stat1探究了內皮細胞CaMK2a-Stat1信號傳導在代謝記憶誘導的sEV miR-15-16分泌上調中的作用,結果表明內皮細胞CaMK2a-Stat1信號傳導介導代謝記憶誘導的血漿sEV miR-15-16上調,并誘導心臟功能障礙。
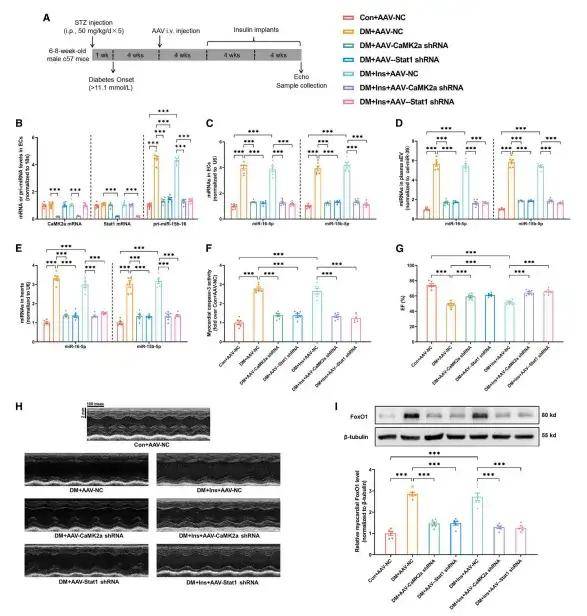
4、早期胰島素治療或O-GlcNAc修飾抑制可阻斷高血糖誘導的記憶信號并預防糖尿病性心肌損傷
前期工作鑒定Thr306為CaMK2a的潛在GlcNAc修飾位點,對該位點進行突變試驗。利用腺病毒在EC中表達外源野生型或T306A突變體CaMK2a-Flag,證明了Thr306位點的O-GlcNAc修飾是CaMK2a促進Stat1磷酸化及后續sEV miR-15-16分泌所必需的。進一步實驗表明O-GlcNAc修飾的CaMK2a在體內具有很高的穩定性。CaMK2a調節pri-miR-15/16的表達,并通過磷酸化Stat1影響心肌細胞。盡管糖尿病發病8周后開始的晚期胰島素治療無法減輕代謝記憶和防止心臟功能障礙的發展,但是探究糖尿病發病初期早期胰島素治療或O-GlcNAc修飾抑制劑(OSMI,1 mg/kg/天)是否能有效阻斷內皮記憶信號和心臟損傷具有重要意義。結果表明,蛋白質O-GlcNA化直接介導糖尿病誘導的有害變化,而早期血糖控制能夠抑制代謝記憶信號傳導并預防糖尿病誘導的損傷。作者進一步驗證了實驗結果的轉化適用性,從糖尿病個體和健康志愿者中提取了血漿sEVs,并通過多元分析發現血漿sEV miR-16-5p和miR-15b-5p在預防糖尿病患者心臟功能障礙方面具有轉化潛力。
結論
本研究表明糖尿病患者治療后盡管血糖恢復正常,但代謝記憶衍生的循環sEV miR-15-16對心肌細胞產生了深遠而持續的有害影響。高糖誘導的CaMK2a/O-GlcNA化的正反饋回路即使在GLU正常化后也能維持內皮CaMK2a-Stat1通路的激活,該通路介導代謝記憶并促進sEV miR-15-16的持續釋放。靶向內皮O-GlcNAc-CaMK2a-Stat1通路或sEV miR-15-16為消除糖尿病代謝記憶及其相關并發癥提供了一種有前景的治療方法。


AAV感染后TUNEL和DAPI染色的代表性圖像

小鼠頸動脈中CD31(內皮細胞標志物)與CaMK2a-Flag共免疫熒光染色的代表性圖像

Ad-Stat1表達后 Stat1及miR-16-5p 等相關基因的水平檢測
研究背景
糖尿病(DM)的患病率顯著增加,已成為一個主要的全球公共衛生問題。眾所周知,糖尿病顯著增加了心力衰竭的風險,與缺血性心臟病或其他并發癥的存在無關;另一方面,臨床證據也表明,在心力衰竭患者中,糖尿病是不良預后的關鍵決定因素。盡管治療后血糖恢復正常,但高血糖產生的適應不良特征仍然存在。據推測,血管系統中早期的高血糖可能會被內皮細胞(ECs)記住,從而導致隨后的心血管并發癥。這種現象被稱為“高血糖記憶”或“代謝記憶”,主要用于描述高血糖對血管并發癥的長期負面影響。然而,代謝記憶在糖尿病心肌病或心力衰竭發展中的作用在很大程度上仍不清楚。
研究結果分享
1、代謝記憶產生的sEV miR-15-16上調FoxO1信號傳導
作者通過體內外實驗研究發現在8周的高血糖(HG)應激后,糖尿病來源的循環小細胞外囊泡(sEVs)對心肌細胞產生持續性不利影響,并在健康動物中誘導心臟功能障礙,盡管后續血糖恢復正常。這表明HG誘導的循環sEVs表現出“記憶”特征,可能促使糖尿病患者殘留部分心力衰竭風險。考慮到在糖尿病8周時sEVs產生的不良影響,對從8周糖尿病和非糖尿病對照組大鼠血漿中收集的sEVs進行高通量RNA測序,鑒定發現miR-15b-5p和miR-16-5p是代謝記憶產生的循環sEVs中的作用分子。miR-15b-5p和miR-16-5p被轉錄為miR-15-16,位于同一染色體區域,并且高度保守,考慮到兩者的協同作用,后續使用其模擬物或抑制劑探究了miR-15-16誘導心肌細胞凋亡的分子機制。結果表明,sEVs miR-15-16靶向FoxO1信號通路的一系列上游調節因子,并通過上調心肌細胞中的FoxO1發揮促凋亡作用,進而導致心臟功能障礙。

圖1. 代謝記憶產生的sEV miR-15-16上調FoxO1信號傳導
2、抑制內皮細胞miR-15-16可減輕代謝記憶誘導的心臟損傷和功能障礙作者進一步研究發現代謝記憶誘導動脈內皮細胞分泌sEV miR-15-16,為了探索內皮miR-15-16在體內代謝記憶誘導的心臟功能障礙中的作用,作者利用AAV9介導miR-15-16海綿遞送給小鼠,實現了EC特異性的miR-15-16敲低。與NC海綿組相比,EC特異性miR-15-16海綿組血漿sEV miR-15-16的表達顯著降低,表明動脈EC是代謝記憶誘導的血漿sEV miR-15-16的主要來源。此外,在DM或DM+Ins(代謝記憶動物模型)組中,EC特異性miR-15-16敲低降低了心肌miR-15-16的表達,改善了心功能,并抑制了心肌細胞凋亡和FoxO1的表達。這些數據表明,內皮細胞分泌的sEV miR-15-16參與了代謝記憶誘導的心臟損傷和功能障礙。

圖2. 抑制內皮細胞miR-15-16可減輕代謝記憶誘導的心臟損傷和功能障礙
3、敲低內皮細胞CaMK2a-Stat1信號轉導抑制代謝記憶誘導的sEV miR-15-16分泌和心臟功能障礙作者進一步探究了代謝記憶促進ECs分泌sEV miR-15-16的機制,發現HG對miR-15-16的作用可能通過誘導蛋白質O-GlcNAc糖基化介導。糖尿病動脈ECs中O-GlcNAc糖基化、CaMK2a活性、CaMK2a-Stat1結合以及Stat1在Ser727位點的磷酸化均顯著升高,即使后期通過胰島素植入實現血糖正常化,這些指標仍顯著升高。利用腺病毒在ECs中過表達Stat1,實驗發現Stat1可以與pri-miR-15-16啟動子結合,以增強EC中sEV miR-15-16的分泌。隨后,作者通過抑制CaMK2a/Stat1探究了內皮細胞CaMK2a-Stat1信號傳導在代謝記憶誘導的sEV miR-15-16分泌上調中的作用,結果表明內皮細胞CaMK2a-Stat1信號傳導介導代謝記憶誘導的血漿sEV miR-15-16上調,并誘導心臟功能障礙。

圖3. 敲低內皮細胞CaMK2a-Stat1信號轉導抑制代謝記憶誘導的sEV miR-15-16分泌和心臟功能障礙
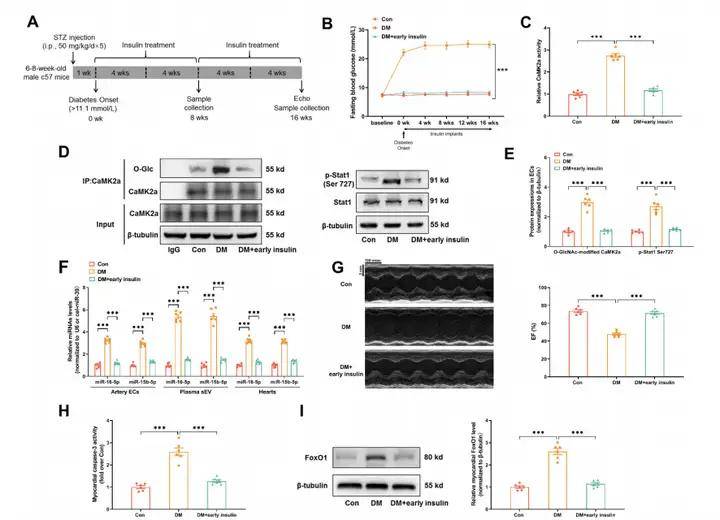
4、早期胰島素治療或O-GlcNAc修飾抑制可阻斷高血糖誘導的記憶信號并預防糖尿病性心肌損傷
前期工作鑒定Thr306為CaMK2a的潛在GlcNAc修飾位點,對該位點進行突變試驗。利用腺病毒在EC中表達外源野生型或T306A突變體CaMK2a-Flag,證明了Thr306位點的O-GlcNAc修飾是CaMK2a促進Stat1磷酸化及后續sEV miR-15-16分泌所必需的。進一步實驗表明O-GlcNAc修飾的CaMK2a在體內具有很高的穩定性。CaMK2a調節pri-miR-15/16的表達,并通過磷酸化Stat1影響心肌細胞。盡管糖尿病發病8周后開始的晚期胰島素治療無法減輕代謝記憶和防止心臟功能障礙的發展,但是探究糖尿病發病初期早期胰島素治療或O-GlcNAc修飾抑制劑(OSMI,1 mg/kg/天)是否能有效阻斷內皮記憶信號和心臟損傷具有重要意義。結果表明,蛋白質O-GlcNA化直接介導糖尿病誘導的有害變化,而早期血糖控制能夠抑制代謝記憶信號傳導并預防糖尿病誘導的損傷。作者進一步驗證了實驗結果的轉化適用性,從糖尿病個體和健康志愿者中提取了血漿sEVs,并通過多元分析發現血漿sEV miR-16-5p和miR-15b-5p在預防糖尿病患者心臟功能障礙方面具有轉化潛力。

圖4. 早期胰島素治療或O-GlcNAc修飾抑制可阻斷高血糖誘導的記憶信號并預防糖尿病性心肌損傷
結論
本研究表明糖尿病患者治療后盡管血糖恢復正常,但代謝記憶衍生的循環sEV miR-15-16對心肌細胞產生了深遠而持續的有害影響。高糖誘導的CaMK2a/O-GlcNA化的正反饋回路即使在GLU正常化后也能維持內皮CaMK2a-Stat1通路的激活,該通路介導代謝記憶并促進sEV miR-15-16的持續釋放。靶向內皮O-GlcNAc-CaMK2a-Stat1通路或sEV miR-15-16為消除糖尿病代謝記憶及其相關并發癥提供了一種有前景的治療方法。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





