抑制劑A83-01的作用機(jī)制及在干細(xì)胞與類器官培養(yǎng)中的應(yīng)用
干細(xì)胞和類器官是當(dāng)下備受矚目的兩個(gè)研究領(lǐng)域,但對(duì)于初次接觸該領(lǐng)域的實(shí)驗(yàn)人員而言,往往要面對(duì)的難題是如何高效的完成類器官和干細(xì)胞的培養(yǎng),以及種類眾多的小分子調(diào)節(jié)劑和細(xì)胞因子該如何選擇。AbMole為大家介紹一款在上述兩個(gè)領(lǐng)域中應(yīng)用廣泛的明星分子-A 83-01(AbMole,M5037),它是一種強(qiáng)效的TGF-β I 型受體抑制劑,常被用于誘導(dǎo)干細(xì)胞重編程、維持干細(xì)胞的自我更新、誘導(dǎo)類器官成型、維持類器官的穩(wěn)定性。AbMole為全球科研客戶提供高純度、高生物活性的抑制劑、細(xì)胞因子、人源單抗、天然產(chǎn)物、熒光染料、多肽、靶點(diǎn)蛋白、化合物庫(kù)、抗生素等科研試劑,全球大量文獻(xiàn)專利引用。
一、A 83-01的作用機(jī)制
A 83-01(AbMole,M5037)能夠特異性地結(jié)合TGF-β I型受體(如ALK5、ALK4和ALK7),從而抑制這些受體的活性。TGF-β信號(hào)通路在細(xì)胞的增殖、分化、遷移和凋亡等多種生物學(xué)過(guò)程中起著關(guān)鍵作用。A 83-01通過(guò)阻斷TGF-β信號(hào)通路,能夠調(diào)節(jié)細(xì)胞的這些生物學(xué)行為,為干細(xì)胞和類器官的研究提供了有力的工具。
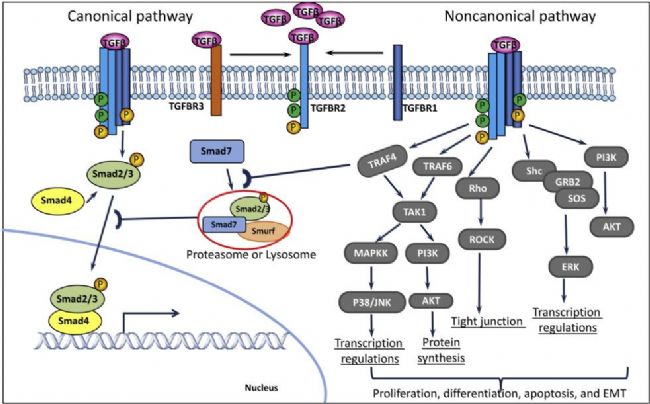
圖 1. TGF-β受體及其相關(guān)的信號(hào)通路示意圖[1]
二、A 83-01的研究應(yīng)用
1.A 83-01誘導(dǎo)干細(xì)胞的重編程
在干細(xì)胞研究中,A 83-01(AbMole,M5037)被廣泛用于促進(jìn)細(xì)胞的重編程。研究表明,A 83-01能夠用于小鼠成纖維細(xì)胞的重編程。并且通過(guò)抑制TGF-β信號(hào)通路,A 83-01減少了細(xì)胞在重編程過(guò)程中因TGF-β信號(hào)激活而產(chǎn)生的分化壓力,從而促進(jìn)了細(xì)胞向多能狀態(tài)的轉(zhuǎn)變。
2.A 83-01維持干細(xì)胞多能性和自我更新能力
干細(xì)胞的多能性和自我更新能力是干細(xì)胞研究和應(yīng)用的基礎(chǔ)。然而在培養(yǎng)過(guò)程中可能會(huì)面臨著干性丟失的問(wèn)題。A 83-01(AbMole,M5037)通過(guò)有效阻斷TGF-β信號(hào)傳導(dǎo),減少干細(xì)胞的分化趨勢(shì),維持其多能性和自我更新能力。在干細(xì)胞培養(yǎng)過(guò)程中,添加合適濃度的 A 83-01,能夠延長(zhǎng)干細(xì)胞在體外的培養(yǎng)時(shí)間,保持其未分化狀態(tài),為后續(xù)實(shí)驗(yàn)提供穩(wěn)定、優(yōu)質(zhì)的細(xì)胞來(lái)源。2014年,AbMole的兩款抑制劑分別被西班牙國(guó)家心血管研究中心和美國(guó)哥倫比亞大學(xué)用于動(dòng)物體內(nèi)實(shí)驗(yàn),相關(guān)科研成果發(fā)表于頂刊 Nature 和 Nature Medicine。
3.A 83-01促進(jìn)類器官培養(yǎng)成型
A 83-01(AbMole,M5037)可以促進(jìn)類器官的形成和維持其穩(wěn)定性。研究表明,A 83-01能夠用于肝臟類器官[2]、前列腺類器官[3]、胃及腸道類器官的長(zhǎng)期培養(yǎng)[3]。在類器官的具體培養(yǎng)方案中,A 83-01(AbMole,M5037)常與Y-27632(AbMole,M1817)、CHIR99021(AbMole,M1692)、DAPT(AbMole,M1746)、Forskolin(AbMole,M2191)等組成“黃金搭檔”,調(diào)控類器官的細(xì)胞分化和功能。
三、范例詳解
1.Cancer Cell. 2024 Apr 8;42(4):535-551.e8.
北京大學(xué)和鄭州大學(xué)的科研人員在上述文章中,構(gòu)建了一個(gè)大規(guī)模的原發(fā)性肝癌(PLC)類器官生物庫(kù),實(shí)驗(yàn)人員利用該生物庫(kù)進(jìn)行了基因組和轉(zhuǎn)錄組學(xué)的分析,以綜合剖析PLC的腫瘤間和腫瘤內(nèi)異質(zhì)性,并進(jìn)行了藥物敏感性篩選。在實(shí)驗(yàn)中,科研人員還發(fā)現(xiàn)了具有預(yù)測(cè)性的分子生物標(biāo)志物,并且證明c-Jun可通過(guò)JNK和β-catenin 信號(hào)傳導(dǎo)誘導(dǎo)PLC對(duì)lenvatinib的耐藥,c-Jun抑制劑和lenvatinib之間表現(xiàn)出良好的協(xié)同效應(yīng)。在上述大規(guī)模類器官培養(yǎng)中,實(shí)驗(yàn)人員使用了來(lái)自AbMole的A 83-01(AbMole,M5037)。
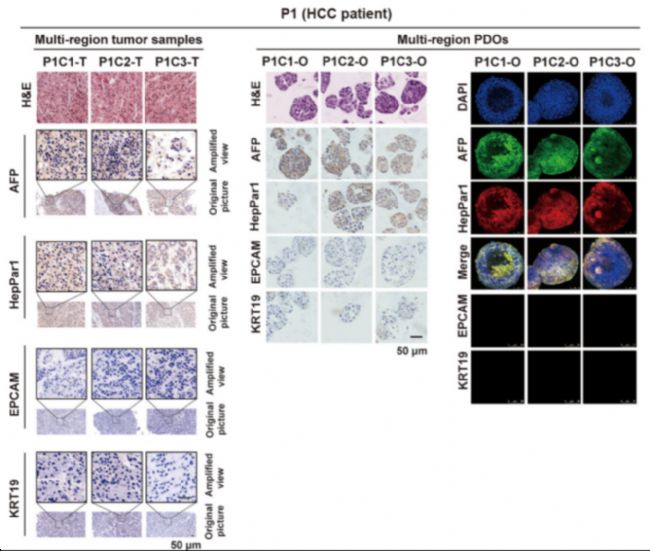
圖 2. 基于原發(fā)性肝癌(PLC)構(gòu)建的類器官及其H&E、免疫熒光染色[4]
2.Chemical Engineering Journal 514 (2025) 162930.
北京大學(xué)和西安交通大學(xué)的科研人員開發(fā)了一種結(jié)合ZnO納米顆粒和工程細(xì)胞膜的核殼納米顆粒系統(tǒng)Z@CMDH,并將其用于抑制骨肉瘤(OS)。在細(xì)胞內(nèi),該納米系統(tǒng)中的DPβCD外殼可消耗腫瘤細(xì)胞膜中的膽固醇進(jìn)而增加細(xì)胞剛度,這種耗竭會(huì)破壞脂筏的穩(wěn)固性,降低了PD-L1在細(xì)胞膜上的穩(wěn)定性,減弱腫瘤細(xì)胞對(duì)毒性T細(xì)胞(CTL)的抵抗力,抑制PI3K-Akt信號(hào)傳導(dǎo),并損害細(xì)胞對(duì)氧化應(yīng)激的抵抗力。另一方面,ZnO 納米顆粒可誘導(dǎo)氧化應(yīng)激,促進(jìn)免疫原性細(xì)胞死亡(ICD)。而在細(xì)胞外,透明質(zhì)酸酶介導(dǎo)的細(xì)胞外基質(zhì)降解降低了腫瘤組織的剛度,以抵消CTL中Piezo1介導(dǎo)的細(xì)胞殺傷能力抑制。這種雙重調(diào)節(jié)可協(xié)同增強(qiáng)免疫反應(yīng),促進(jìn)腫瘤抑制和免疫細(xì)胞浸潤(rùn)。在體外和體內(nèi),Z@CMDH + αPDL1顯著抑制了腫瘤生長(zhǎng),減少轉(zhuǎn)移,并誘導(dǎo)ICD。轉(zhuǎn)錄組學(xué)和類固醇代謝分析揭示了腫瘤相關(guān)通路的改變,包括免疫原性途徑的上調(diào)和類固醇代謝的調(diào)節(jié),再次證實(shí)了生物力學(xué)調(diào)節(jié)和免疫檢查點(diǎn)抑制的協(xié)同作用。在文章中,實(shí)驗(yàn)人員還構(gòu)建了一種OS腫瘤類器官,并將其與淋巴細(xì)胞共培養(yǎng),以驗(yàn)證上述納米系統(tǒng)的效果和機(jī)制,在類器官培養(yǎng)過(guò)程中,科研使用了由AbMole提供的A 83-01(AbMole,M5037)和Y-27632(AbMole,M1817)[5]。
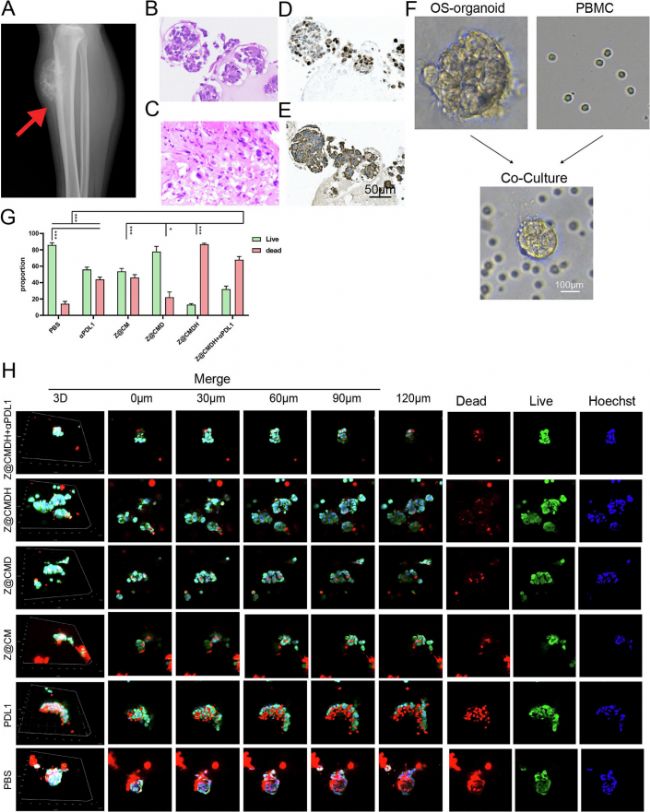
圖 3. Z@CMDH在腫瘤類器官和PBMC共培養(yǎng)中的效果評(píng)價(jià)[5]
參考文獻(xiàn)及鳴謝
[1] A. Vander Ark, J. Cao, X. Li, TGF-β receptors: In and beyond TGF-β signaling, Cellular signalling 52 (2018) 112-120.
[2] Y. Hu, X. Hu, J. Luo, et al., Liver organoid culture methods, Cell & bioscience 13(1) (2023) 197.
[3] Therese Seidlitz, Bon-Kyoung Koo, Daniel E. Stange, Gastric organoids—an in vitro model system for the study of gastric development and road to personalized medicine, Cell Death & Differentiation 28(1) (2021) 68-83.
[4] H. Yang, J. Cheng, H. Zhuang, et al., Pharmacogenomic profiling of intra-tumor heterogeneity using a large organoid biobank of liver cancer, Cancer cell 42(4) (2024) 535-551.e8.
[5] Linbang Wang, Ziyu Wang, Xuan Fu, et al., Intracellular and extracellular stiffness regulation in osteosarcoma: Overcoming mechano-immune checkpoints to enhance anti-osteosarcoma immunity, Chemical Engineering Journal 514 (2025) 162930.
- CPG載體助力核酸合成實(shí)驗(yàn)成功率翻倍
- PROTAC透膜CD36蛋白介導(dǎo)的內(nèi)吞機(jī)制助力藥物研究
- 2025年FDA獲批藥物活性成分和適應(yīng)癥盤點(diǎn) (上)
- 輔酶A及其衍生物、代謝因子助力調(diào)控多種疾病
- 動(dòng)物造模劑揭示HLF/PPARα軸通過(guò)腸道微生物的細(xì)胞外囊泡調(diào)節(jié)MAFLD
- pH熒光探針的基本原理、優(yōu)勢(shì)及應(yīng)用領(lǐng)域
- 下丘腦分泌的蛋白質(zhì)激素Raptin在調(diào)節(jié)食欲和體重中的作用
- 槲皮素Quercetin的抗腫瘤與抗衰老作用機(jī)制及應(yīng)用案例
- 賽默飛低氮過(guò)硫酸鉀(S36337)新品上市,邀您免費(fèi)試用
- MCE直播預(yù)告:動(dòng)物給藥之局部給藥方式及注意事項(xiàng)
- MCE邀您參加BioCon 2025生物藥全生命周期技術(shù)年會(huì)
- MCE中國(guó)6月促銷:天然產(chǎn)物產(chǎn)品限時(shí)7折秒殺
- 注冊(cè)會(huì)員,AbMole細(xì)胞實(shí)驗(yàn)4大金剛試劑任一款免費(fèi)送
- MCE六月展會(huì)預(yù)告:人工智能大會(huì)&干細(xì)胞研究會(huì)議
- MCE HOLO系列均相免疫分析試劑盒上新5折嘗鮮價(jià)
- MCE直播預(yù)告:PROTAC研究新進(jìn)展和設(shè)計(jì)新思路
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





