文獻解讀:新型線粒體靶向納米顆粒聯合光動力療法激活免疫抗擊腫瘤

近日,華中科技大學生命科學技術學院李子福教授、楊祥良教授團隊在納米顆粒光動力免疫治療研究方面取得了新進展。相關研究成果已經發表在國際權威期刊《Biomaterials》(IF=12.8、一區top期刊)上。
三陰性乳腺癌(TNBC)因缺乏雌激素受體(ER)、孕激素受體(PR)和人表皮生長因子受體2(HER2)的表達,傳統靶向治療效果有限。近年,免疫治療尤其是針對PD-1/PD-L1免疫檢查點的抑制劑在TNBC治療中展現出潛力,但高表達PD-L1的腫瘤細胞及腫瘤干細胞(CSCs)會通過免疫抑制微環境顯著削弱T細胞活性,導致臨床響應率低于20%。盡管PD-1/PD-L1抗體已在部分患者中獲得緩解,但其三陰性乳腺癌(TNBC)因缺乏雌激素受體(ER)、孕激素受體(PR)和人表皮生長因子受體2(HER2)的表達,傳統靶向治療效果有限。近年,免疫治療尤其是針對PD-1/PD-L1免疫檢查點的抑制劑在TNBC中展現出潛力,但其高表達PD-L1的腫瘤細胞及腫瘤干細胞(CSCs)通過免疫抑制微環境顯著削弱T細胞活性,導致臨床響應率低于20%。盡管PD-1/PD-L1抗體已在部分患者中獲得緩解,其高成本、全身免疫毒性及耐藥性仍是重大挑戰。此外,光動力療法(PDT)等手段可通過誘導免疫原性細胞死亡(ICD)提升腫瘤免疫原性,但腫瘤缺氧環境會削弱PDT的療效。因此,開發低成本、高特異性且能多維度打破免疫抑制微環境的聯合療法迫在眉睫。
近年來,銅離子載體(如雙硫侖衍生物CuET)因靶向線粒體代謝的獨特機制備受關注。研究揭示,CuET通過干擾線粒體三羧酸循環(TCA)的核心酶類,引發脂酰化蛋白聚集及鐵硫簇蛋白丟失,導致線粒體氧化應激與能量代謝紊亂,從而激活AMPK通路。AMPK作為能量應激傳感器,可磷酸化PD-L1并觸發其泛素-蛋白酶體降解,為克服PD-L1介導的免疫逃逸提供新思路。與此同時,CuET的線粒體損傷功能可降低腫瘤細胞的氧消耗,緩解腫瘤缺氧環境,理論上可增強PDT中單線態氧(¹O₂)的生成效率。然而,CuET極端疏水且易聚集的特性限制了其體內遞送效率。因此,如何構建兼具藥物遞送與免疫調控功能的納米載體,實現CuET與PDT的協同增效,成為當前亟待解決的關鍵科學問題。
為解決上述問題,研究人員創新性地設計了一種基于CuET與吲哚菁綠(ICG)的自組裝納米復合物(CuET/ICG NPs)。ICG作為近紅外光敏劑及載體模板,通過分子間疏水作用與π-π堆疊,與CuET共同形成穩定性優異的納米顆粒。此載體無需額外輔料,解決了CuET的遞送難題。在機制層面,CuET通過干擾線粒體功能激活AMPK通路,下調PD-L1表達;同時削弱腫瘤細胞呼吸作用,緩解缺氧以增強ICG的PDT效率,放大ICD效應并促進樹突細胞成熟。該策略將納米材料與代謝調控、光動力治療相結合,在重塑腫瘤免疫微環境的同時精準靶向CSCs,突破了單一療法的局限性。此研究不僅為TNBC免疫治療提供了多模態協同策略,也為基于代謝干預的納米藥物研發開辟了新路徑。
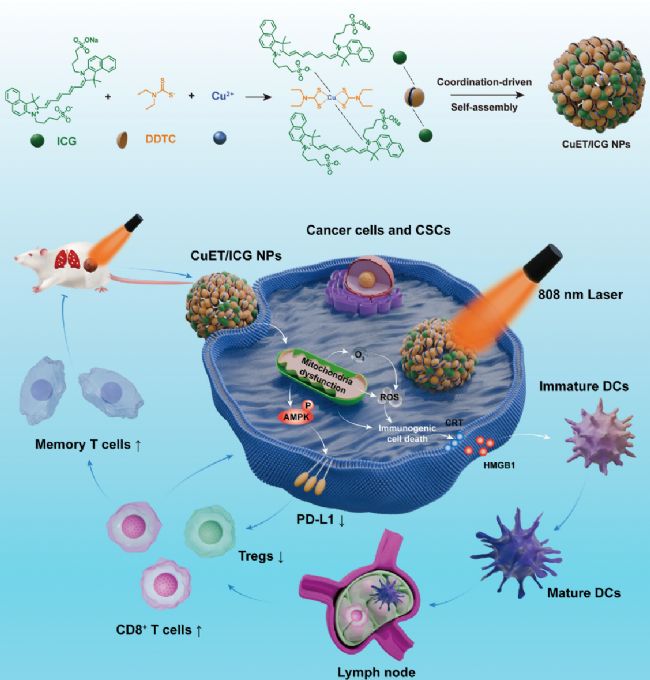
圖1.CuET/ICG納米復合物形成以及與PDC組合協同激活抗腫瘤免疫的示意
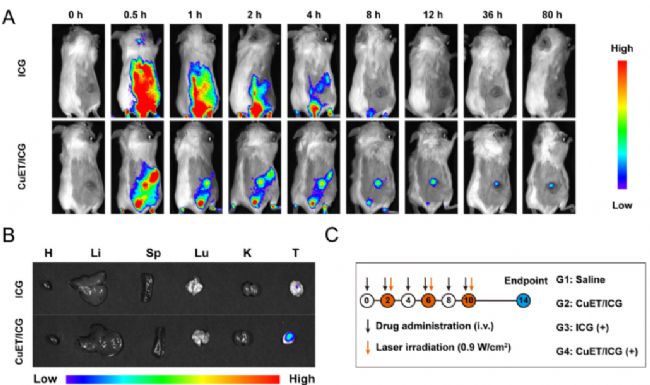
圖2. 納米顆粒活體和離體熒光成像
為了研究納米顆粒的腫瘤靶向性、器官分布以及可能的代謝途徑,研究人員給荷瘤小鼠靜脈注射CuET/ICG納米顆粒后,通過廣州博鷺騰生物科技有限公司AniView多模式動物活體成像系統動態監測其生物分布,發現ICG熒光信號在腫瘤區域隨時間顯著增強,提示納米顆粒通過增強滲透與滯留效應(EPR效應)實現靶向蓄積。離體成像顯示,注射后80小時,腫瘤組織中熒光強度仍為其他器官(心、肝、脾、肺、腎)的2.3倍以上,證實其長效滯留特性;其中肝臟因單核吞噬細胞系統(MPS)的主動攝取呈現中度熒光(占腫瘤信號的67%),而腸道內容物中熒光信號(約30%)表明納米顆粒通過肝膽途徑代謝排出。與游離ICG組相比,CuET/ICG納米顆粒在腫瘤中的熒光強度提高了41%,且保留時間延長4倍以上,得益于其自組裝結構增強了光穩定性并減緩了腎臟清除。這種腫瘤特異性蓄積與時空可控的代謝途徑,不僅為光動力治療提供了持續的¹O₂生成保障,還降低了系統性免疫毒性風險,凸顯該納米系統在精準遞送和副作用控制上的雙重優勢。
論文鏈接:
https://doi.org/10.1016/j.biomaterials.2025.123094





