HDX-MS助力揭示FXR-RXRα與SRC1的互作機制
客戶文章
最/新研究成果展示
▶ 發表時間:2025年3月13日
▶ 期刊:《Communications Biology》(JCR1區)
▶ 發表團隊:廣州生物醫藥健康研究院劉勁松研究員
▶ 核心內容:該研究使用揭示了FXR-RXRα與SRC1相互作用的分子機制,提出了首/個包含FXR-RXRα-DNA和SRC1-NRID的多域復合物模型。研究結果不僅為理解核受體復合物的動態調控機制提供了新的視角,還為代謝相關脂肪性肝病(MAFLD)和代謝功能障礙相關脂肪性肝炎(MASH)的治療提供了新的思路。

研究背景:FXR-RXRα與SRC1相互作用的研究難題
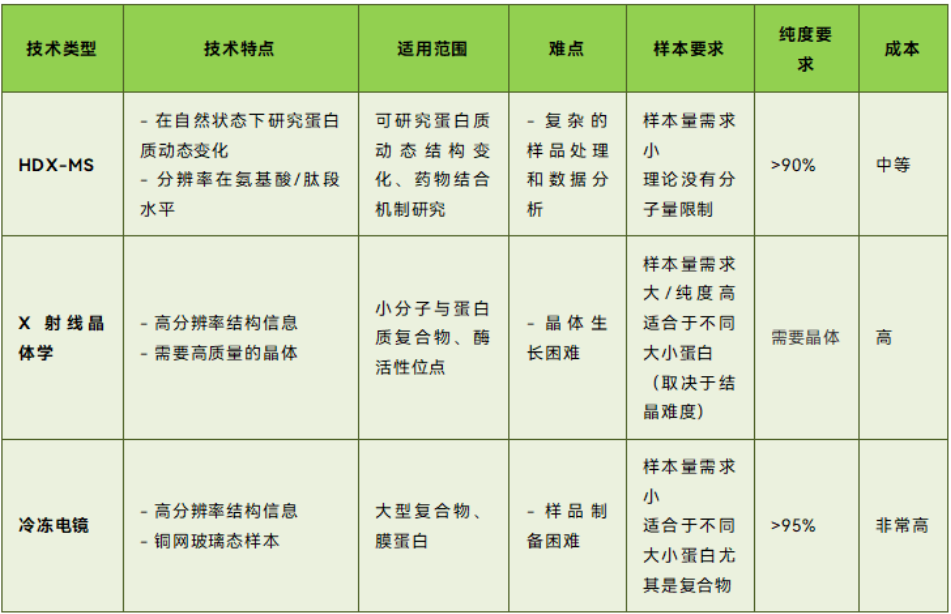
FXR(法尼酯X受體)是一種與代謝紊亂相關的核受體,其與RXRα形成的異二聚體在基因轉錄調控中扮演著重要角色。SRC1作為重要的共激活因子,能夠與FXR-RXRα相互作用,進而影響基因表達。然而,這種相互作用的分子機制一直未能完全解析。本研究采用HDX-MS表征技術解決了本研究中最關鍵的問題,即DNA和激動劑對于FXR-RXRα 和SRC1結合引起的影響。相對于傳統的結構生物學技術X-射線衍射難以表征多域結構和動態變化以及冷凍電鏡技術則對樣品的制備要求極高且成本高昂等問題,HDXMS具有其獨特的優勢。
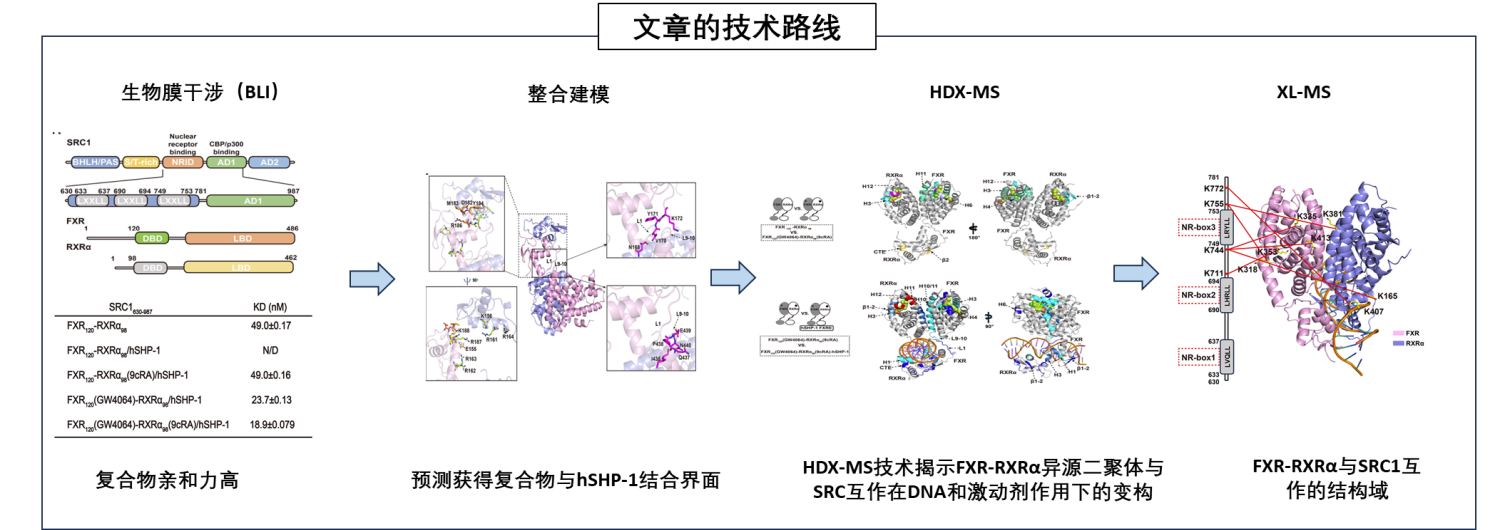
技術路線與結論
▷ 首先,研究者們使用生物膜干涉(BLI) 實驗檢測了不同狀態下FXR-RXRα與SRC1的結合親和力(KD值)。結果顯示,激動劑和DNA(hSHP-1) 的結合顯著影響SRC1與FXR-RXRα的結合能力,結合水平在nM水平,表明親和力較高。
▷ 接著,通過整合建模方法預測FXR-RXRα-hSHP-1可能的互作區域。
▷ 進一步的,通過HDX-MS實驗展示了激動劑和DNA結合對FXR-RXRα構象的影響。結果顯示,激動劑結合穩定了FXR的LBD,而DNA結合進一步增強了這種穩定性,并促進了LBD和DBD之間的相互作用。
▷ 最后,通過交聯質譜等實驗,進一步驗證FXR-RXRα與SRC1互作的精細互作區域位于SRC2的NR-box3結構域。
HDX-MS 技術揭示動態調控機制
HDX-MS技術能檢測蛋白質在不同條件下氫原子與氘原子的交換速率,揭示蛋白質結構的穩定性和靈活性。在這項研究中,HDX-MS技術被用來分析FXR-RXRα在不同狀態下的構象變化,包括與激動劑、DNA結合后的變化。
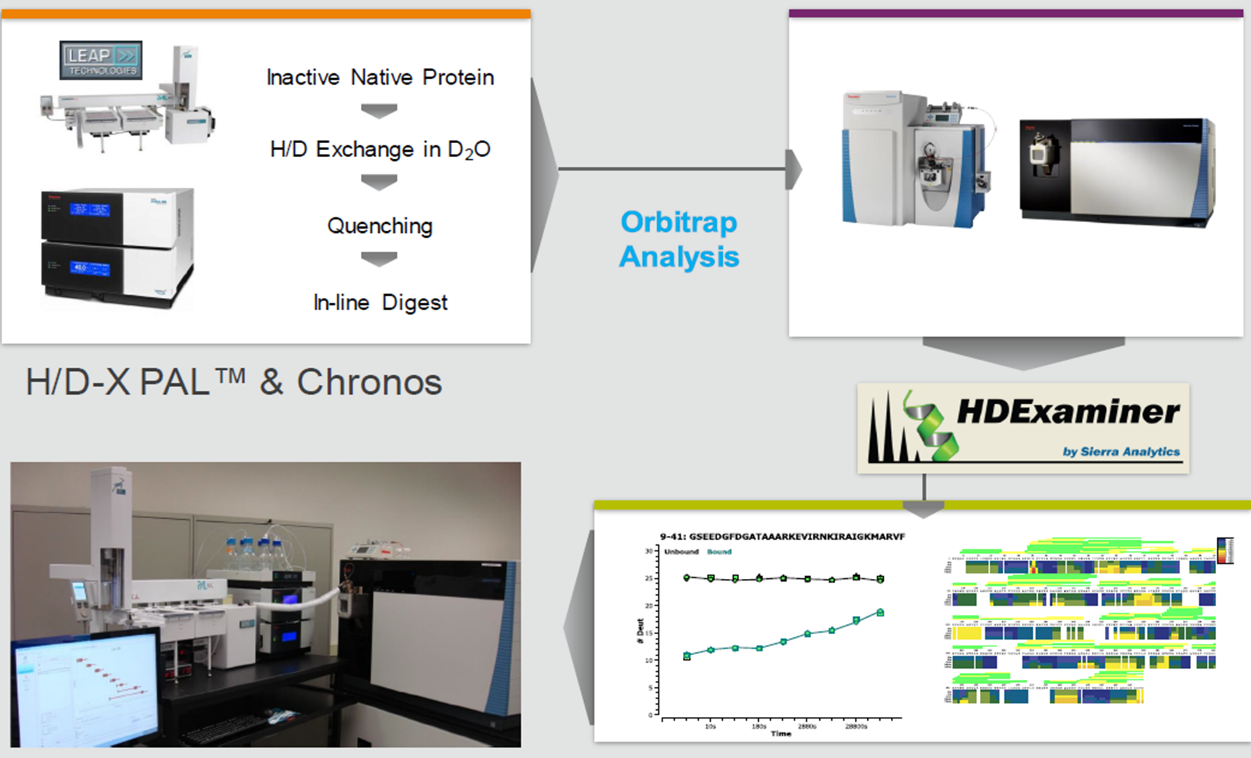
實驗設計: 研究人員制備了三種樣品:未結合激動劑的FXR-RXRα、結合激動劑的FXR-RXRα以及結合激動劑和DNA的FXR-RXRα。所有樣品均在生理條件下進行處理,以確保實驗結果的生理相關性。
實驗過程:樣品在不同時間點(0秒、10秒、30秒、120秒、600秒和1800秒)進行氘化處理,隨后通過質譜分析檢測蛋白質肽段的氘化程度。實驗重復三次,以確保結果的可靠性。
數據分析:通過比較不同狀態下蛋白質肽段的氘化速率,研究人員能夠識別出在激動劑和DNA結合后發生顯著構象變化的區域。具體結果如下:
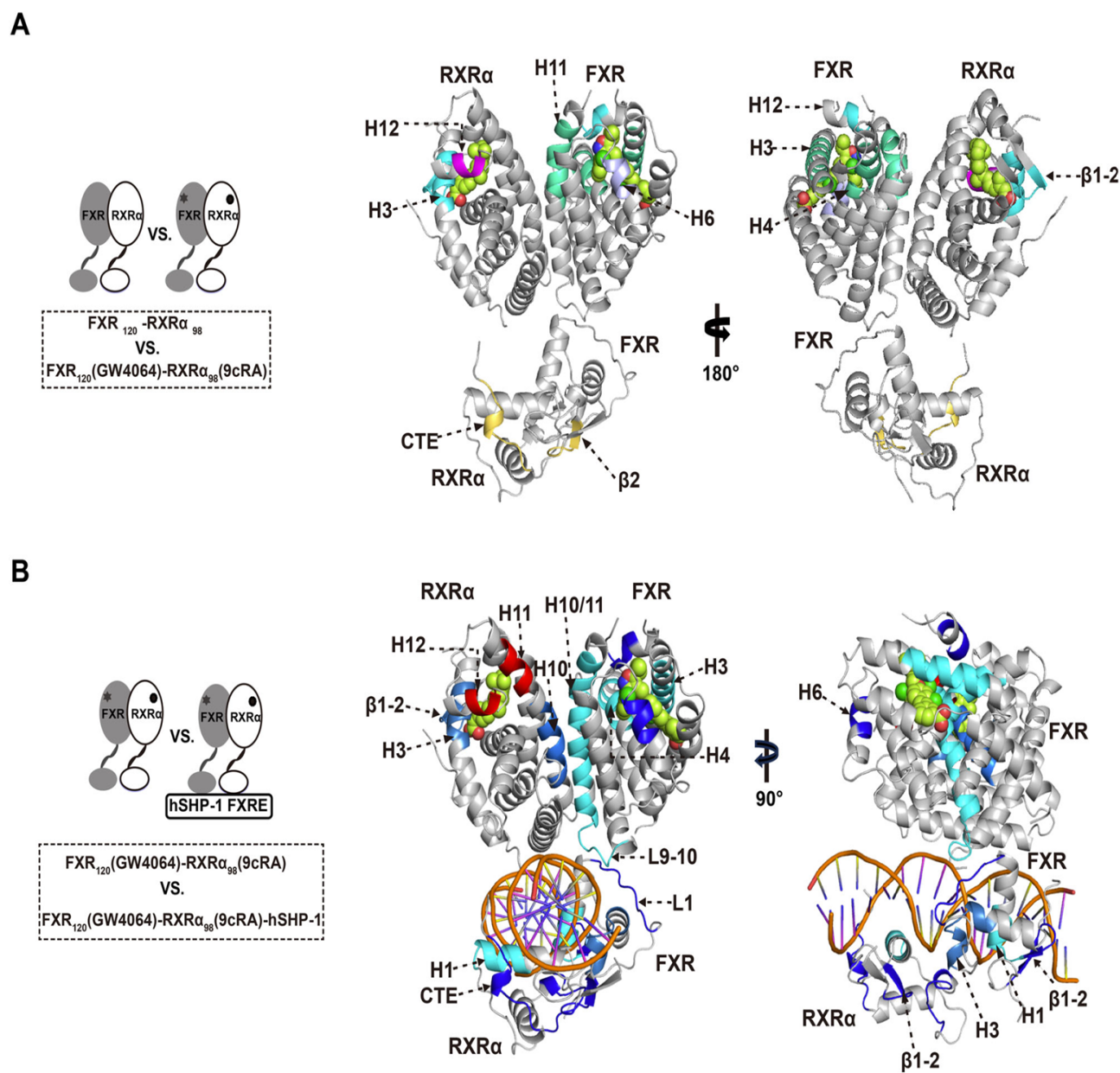
1. 激動劑結合的影響:激動劑結合后,FXR的H3、H4、H6和H12區域的氘化速率顯著降低,表明這些區域的結構變得更加穩定。這與激動劑結合后形成的共激活因子結合表面的穩定化密切相關。
2. DNA結合的影響:當FXR-RXRα與DNA結合后,其LBD(配體結合域)和DBD(DNA結合域)的氘化速率也發生了顯著變化。特別是FXR-LBD的H11和H12區域,其靈活性增加,這可能與共激活因子的招募有關。
3. 整體構象變化:DNA結合進一步穩定了FXR-RXRα的異二聚體界面,增強了LBD之間的二聚化,從而促進了共激活因子的招募。
HDX-MS 與傳統結構表征技術的比較表.HDX-MS 與傳統結構表征技術的比較
百蓁團隊已與該客戶課題組展開深度合作,利用HDXMS技術解決蛋白質復合物的精細結構分析問題,取得了豐碩的成果,發表JCR1區高水平文章3篇。
百蓁生物提供全套的 HDX-MS 服務體系,以發現各種類型樣品,例如單克隆抗體 (mAb)、抗體-藥物偶聯物 (ADC)、病毒衣殼、生物仿制藥等蛋白質構象、動力學、相互作用的信息,可用于生物仿制藥評價、治療性蛋白質QC、藥理學研究等應用領域。百蓁生物HDX-MS 服務體系優勢如下:
百蓁實驗平臺的優勢:
a. 低溫精控全自動化樣品前處理系統,低回交率,高重現性,高定量準確性;實現秒到小時時間尺度的蛋白質高級結構精確表征;
b. 搭載Thermo Orbitrap超高分辨三合一質譜儀,Top-Down、Middle-Down、Bottom-Up三種分析模式,CID、HCD、ETD多種碎裂方式,提升質譜采集數據廣度與覆蓋度;
c. 自主軟件PEAKS®平臺深度解析質譜數據,獲取更高深度和準確度肽段信息;
HDX-MS 方法的優勢:
a. 蛋白質在溶液中處于天然狀態而非晶體狀態,直接鑒定蛋白復合體構象;
b. 能夠進行蛋白質結構動態變化的研究,包括變化中的活性位點及表位;
c. 質譜檢測靈敏度高,蛋白質樣品用量少(微克級);對樣品純度要求低;質譜分析速度快,極大縮短實驗周期。
數據分析與結果呈現的優勢:
a. HDExaminer定量分析結合人工校準,精確分析氘摻入量變化趨勢,可完成抗體表位分析、抗體批次間差異效應分析、蛋白質相互作用分析、蛋白質-配體相互作用分析、蛋白質動態結構變化分析等多種需求。
b. 多種可視化結果呈現方式,并可以通過pyMOL或Chimera渲染到蛋白質晶體結構,簡潔形象。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





