MUC1的結構、表達及在腫瘤細胞中的作用機制
引言
MUC1(Mucin1,又稱CD227、EMA、MCD、PEM、PUM、KL-6及MAM6)是一種高度糖基化的跨膜粘蛋白,主要表達于上皮細胞的管腔表面,起到保護上皮細胞免受外界環境損傷的作用。在腫瘤發生發展過程中,MUC1的表達水平顯著升高,其蛋白質結構、糖基化模式和細胞定位均發生顯著改變。這種異常的MUC1表達通過調控多種信號通路,在腫瘤細胞代謝、凋亡抵抗、上皮間質轉化及轉移等過程中發揮關鍵作用。值得注意的是,腫瘤細胞中MUC1的糖基化異常會導致新的抗原表位暴露,這些獨特的表位為腫瘤的診斷和治療提供了特異性靶點。目前針對MUC1的靶向治療策略主要包括單克隆抗體、抗體藥物偶聯物、核酸適配體以及腫瘤疫苗等,部分藥物已進入臨床試驗階段。
MUC1的結構
MUC1基因定位于1號染色體q22區,由7個外顯子和6個內含子組成,編碼MUCIN蛋白家族中的I型跨膜蛋白成員。通過選擇性剪接機制,MUC1可產生多種異構體,目前已鑒定出70余種,主要包括MUC1/A、MUC1/B、MUC1/C、MUC1/D、MUC1/X、MUC1/Y等不同類型。在正常上皮細胞中,MUC1呈現極性分布特征,主要定位于細胞頂膜表面;而在腫瘤細胞中,這種極性分布特征完全喪失。MUC1蛋白在合成后會在空間應力作用下發生水解,形成兩個通過共價鍵連接的多肽片段:MUC1-C和MUC1-N。其中MUC1-C包含胞外區、跨膜區和胞內區三個功能域,其胞外區是EGFR等受體激酶的識別位點,跨膜區負責將蛋白錨定在細胞膜上并參與信號轉導,胞內區則含有多個磷酸化位點和蛋白結合位點,在細胞內信號傳遞中起關鍵作用。MUC1-N段含有多個可變數量的串聯重復序列,這些重復序列形成的多肽骨架為糖基化修飾提供了結構基礎。在腫瘤微環境中,MUC1-N/MUC1-C復合體的穩定性被破壞,導致MUC1-N片段脫落和MUC1-C片段激活,這一過程不僅影響腫瘤的免疫逃逸,還可能中和靶向MUC1的治療性抗體。

MUC1的表達
大量臨床研究表明,MUC1在乳腺癌、膀胱癌、胰腺癌和卵巢癌等多種惡性腫瘤中呈現顯著高表達,且其表達水平與患者不良預后密切相關。值得注意的是,MUC1在正常組織和腫瘤組織中的作用存在顯著差異。在正常生理狀態下,MUC1通過形成糖基化保護屏障維持上皮細胞的穩態;而在腫瘤發生過程中,異常高表達的MUC1通過改變糖基化模式和細胞內定位,參與調控多條促腫瘤信號通路。

MUC1在腫瘤細胞中的作用
腫瘤代謝重編程
腫瘤細胞通過代謝重編程滿足其快速增殖的能量需求,而MUC1正是這一過程的關鍵調控因子。研究表明,MUC1可通過調控HIF-1α的表達,幫助腫瘤細胞適應缺氧微環境。在子宮內膜癌中,AGR2通過激活MUC1/HIF-1α信號軸,上調糖酵解關鍵酶的表達,促進葡萄糖攝取和乳酸產生,從而加速腫瘤進展。此外,MUC1還能增強TIGAR表達,引導糖酵解中間產物進入磷酸戊糖途徑,為腫瘤細胞提供充足的生物合成原料。在脂代謝方面,MUC1通過上調膽固醇和脂肪酸代謝相關基因的表達,促進他莫昔芬耐藥性的產生。
上皮間質轉化和腫瘤轉移過程
MUC1通過JAK/STAT信號通路與STAT1相互作用,刺激IFITM1的表達,進而促進乳腺癌細胞發生上皮間質轉化。在三陰性乳腺癌中,MUC1-C通過激活STAT3,與pSTAT3形成轉錄復合物驅動Twist1基因表達,進而協同促進EMT轉化轉錄因子的表達。此外,MUC1-C還能通過與ZEB1啟動子區結合的NF-κB p65形成轉錄復合物,促進ZEB1的表達,同時抑制miR-200C等上皮分化誘導因子的轉錄,最終導致EMT的發生。在腎細胞癌中,SNAI2與MUC1形成正反饋調節環路,共同促進EMT進程。

凋亡抵抗
MUC1-CD可通過直接結合caspase-8 p18片段,阻止其向死亡誘導信號復合體的募集,從而抑制死亡受體途徑誘導的細胞凋亡。在化療藥物應激條件下,MUC1通過激活Akt/c-Flip/COX-2等促生存信號通路,增強腫瘤細胞的耐藥性。此外,MUC1還能通過JNK1信號通路抑制順鉑誘導的細胞凋亡,并通過JAK/STAT信號通路拮抗雌激素誘導的凋亡過程。
腫瘤干細胞特性維持
MUC1-C可直接與MYC結合,激活多能性因子和神經內分泌分化相關基因的表達。通過與E2F1的相互作用,MUC1-C能夠激活esBAF復合體,驅動NOTCH1、NANOG等干細胞標志物的表達,維持腫瘤干細胞的自我更新能力。在神經內分泌前列腺癌中,MUC1-C整合MYC和E2F1信號通路,參與調控EMT進程和干細胞特性的維持。此外,MUC1-C還通過PBRM1依賴的途徑調控氧化還原平衡,影響腫瘤干細胞的穩態。

表觀遺傳調控
MUC1與DNA甲基化過程存在復雜的相互作用。研究發現MUC1-C可通過與DNMT1和DNMT3b啟動子區結合,調控DNA甲基轉移酶的表達。在胃癌中,MUC1通過降低TFF2基因的甲基化水平,促進其表達,這一過程與患者預后密切相關。
腫瘤耐藥機制
MUC1參與調控多種耐藥相關通路。長期使用曲妥珠單抗會導致MUC1和MUC4表達上調,通過維持HER2的持續激活最終產生耐藥性。研究表明,靶向抑制MUC1-C可有效逆轉乳腺癌細胞對曲妥珠單抗的耐藥性。在順鉑耐藥的尿路上皮癌細胞中,MUC1-C通過激活PI3K-AKT-mTOR信號通路上調MDR1表達,導致耐藥表型。在他莫昔芬耐藥方面,MUC1-C與ERα在Rab31啟動子區形成復合物,減少他莫昔芬與ERα的結合,從而產生耐藥性。這些研究結果為克服腫瘤耐藥提供了新的靶點和策略。
小結
MUC1作為一種高度糖基化的I型跨膜蛋白,在上皮細胞表面形成重要的保護屏障。研究表明,該蛋白在多種惡性腫瘤細胞中呈現顯著高表達,并通過以下多重機制參與腫瘤的發生發展:1.調控腫瘤細胞代謝重編程;2.促進上皮-間質轉化(EMT)過程;3.抑制腫瘤細胞凋亡。這些生物學效應共同促進了腫瘤的惡性進展,并顯著增強了腫瘤細胞對治療的耐藥性。基于這些重要的生物學功能,MUC1已成為腫瘤靶向治療領域極具潛力的新型分子靶標。
目前,科研人員正在積極開發針對MUC1的多種靶向治療策略,包括治療性疫苗、單克隆抗體、抗體藥物偶聯物(ADC)以及核酸適配體等。值得注意的是,部分候選藥物已進入I/II期臨床試驗階段,并展現出令人鼓舞的治療效果。然而,盡管取得了這些重要進展,關于MUC1在腫瘤微環境中的精確作用機制及其調控網絡仍有許多關鍵科學問題有待闡明,這將是未來研究的重要方向。
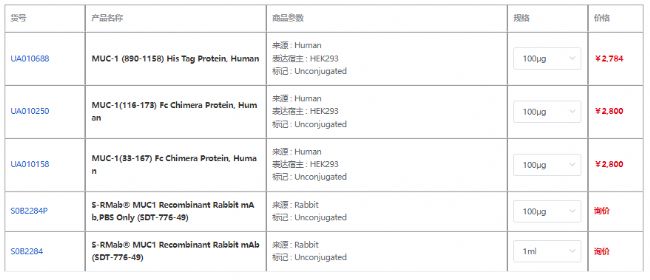
產品信息
 杭州斯達特 (www.starter-bio.com)志在為全球生命科學行業提供優質的抗體、蛋白、試劑盒等產品及研發服務。依托多個開發平臺:重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發平臺(E.coli,CHO,HEK293,InsectCells),已正式通過歐盟98/79/EC認證、ISO9001認證、ISO13485。
杭州斯達特 (www.starter-bio.com)志在為全球生命科學行業提供優質的抗體、蛋白、試劑盒等產品及研發服務。依托多個開發平臺:重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發平臺(E.coli,CHO,HEK293,InsectCells),已正式通過歐盟98/79/EC認證、ISO9001認證、ISO13485。
1.MUC1: An emerging target in cancer treatment and diagnosis.
2.MUC1: structure, function, and clinic application in epithelial cancers.





