肝素鈉Heparin實現動物實驗高效抗凝與抗炎的機制及應用案例
Heparin(Sodium heparinate,肝素鈉,AbMole,M5688)是一種復雜的糖胺聚糖,廣泛存在于哺乳動物的組織中,尤其是肝臟和肺部。Heparin具有豐富的生物學功能,可用于抗炎、抑制凝血因子、抑制鐵調素表達、動物模型研究。AbMole為全球科研客戶提供高純度、高生物活性的抑制劑、細胞因子、人源單抗、天然產物、熒光染料、多肽、靶點蛋白、化合物庫、抗生素等科研試劑,全球大量文獻專利引用。
一、Heparin的結構與功能
1.Heparin(肝素)的結構
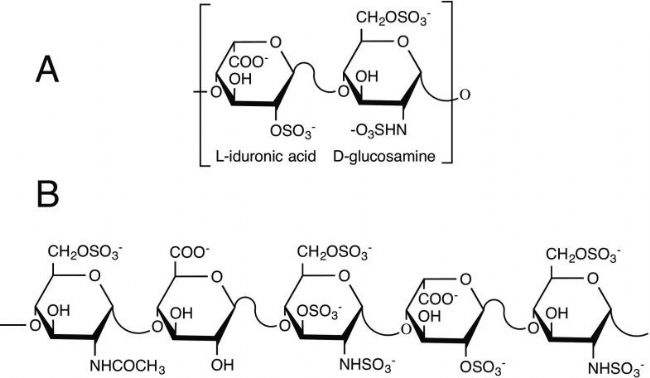
Heparin(Sodium heparinate,肝素鈉,AbMole,M5688)屬于糖胺聚糖家族,是一類復雜的生物大分子。其基本組成單元是由重復的二糖單位構成,這些二糖單位通常包含一個己糖胺(如 D - 葡萄糖胺)和一個糖醛酸(如 L-艾杜糖醛酸或D-葡萄糖醛酸)。在Heparin的結構中,最為普遍的是磺酸化修飾,這種修飾賦予了Heparin強烈的負電性。

圖 1. (A)Heparin中重復的二元結構和(B)Heparin的五糖序列
2.Heparin(肝素)抑制凝血因子
Heparin(Sodium heparinate,肝素鈉,AbMole,M5688)是一種動物實驗廣泛使用的可注射抗凝血劑,常用于實驗動物血液采集和血漿制備,其原理是基于 Heparin 的磺酸基團與 AT-III 分子表面相應氨基酸殘基之間精確的靜電相互作用和結合。這種結合能夠誘導 AT-III 構象發生變化,極大地增強其對凝血酶等凝血因子的抑制活性,從而發揮抗凝血功能。
3.Heparin(肝素)具有抗炎作用
Heparin(Sodium heparinate,肝素鈉,AbMole,M5688)在炎癥反應中也表現出顯著的抑制作用。研究表明,Heparin能夠通過阻斷高遷移率族蛋白B1(HMGB1)與巨噬細胞表面的結合,抑制由脂多糖(LPS)和HMGB1誘導的炎癥反應[1]。此外,Heparin還能抑制caspase-11依賴的炎癥反應[1]。
4.Heparin(肝素)對鐵調素的抑制作用
Heparin(Sodium heparinate,肝素鈉,AbMole,M5688)還被發現具有抑制鐵調素(hepcidin)表達的活性。鐵調素是一種調節全身鐵代謝的關鍵激素,其表達主要由骨形態發生蛋白(BMPs)調控。Heparin通過抑制BMPs激活的SMAD1/5/8蛋白磷酸化,從而抑制鐵調素的表達。這種抑制作用在體外細胞實驗和體內小鼠模型中均得到了證實[2]。
5.Heparin(肝素)用于動物模型研究
在動物模型中,Heparin的抗凝特性被用于研究血栓形成模型或抗凝功能缺陷模型[3]。例如,在兔靜脈血栓模型和小鼠頸動脈血栓模型中,Heparin被證明可以顯著減少血栓形成,即使在抗凝血酶活性較低的情況下[3, 4]。這些研究均表明Heparin在動物模型中可用于探究血栓形成和抗凝機制。Heparin還可以用于構建小鼠腸外營養模型。例如,在一項研究中,通過頸靜脈插管的方式,將含有Heparin的腸外營養液(PN)輸注到小鼠體內[5]。Heparin在上述模型中的主要作用是防止導管內血栓形成,從而確保導管的通暢性。2014年,AbMole的兩款抑制劑分別被西班牙國家心血管研究中心和美國哥倫比亞大學用于動物體內實驗,相關科研成果發表于頂刊 Nature 和 Nature Medicine。
二、范例詳解
1.Int J Biol Macromol. 2023 Dec 31;253(Pt 6):127352.
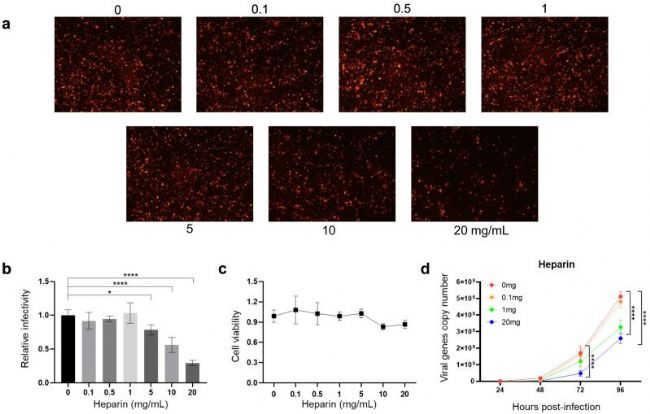
江蘇大學的科研人員在上述文章中研究了糖胺聚糖(Glycosaminoglycans, GAGs),特別是肝素硫酸(Heparan Sulfate, HS)和軟骨素硫酸(Chondroitin Sulfate, CS),在家蠶核型多角體病毒(Bombyx mori nuclear polyhedrosis virus, BmNPV)感染過程中的作用。研究發現,這些糖胺聚糖是BmNPV感染和復制的重要附著因子,其存在與否直接影響病毒的感染效率。上述論文的Heparin(Sodium heparinate,肝素鈉,AbMole,M5688)由AbMole提供[6]。

圖 2. 外源性Heparin對BmNPV感染的中和作用[6]
2.Int J Nanomedicine. 2020 Aug 28;15:6519-6529.
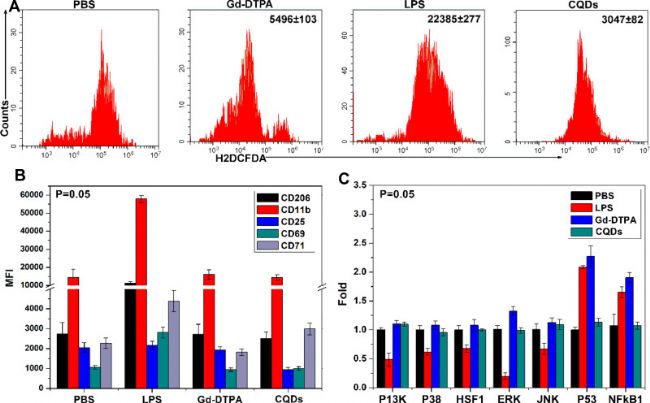
廣州醫科大學、中山大學的研究者們在上述論文中探究了碳量子點(Carbon Quantum Dots, CQDs)在體外和體內環境中的生物相容性和生物相互作用,特別是其在光學成像中的應用。在動物實驗中,實驗人員采集了小鼠眼球血進行了中性粒細胞ROS水平、外周血中CD標志物表達等指標的分析,在取血過程中,使用了AbMole的Heparin(Sodium heparinate,肝素鈉,AbMole,M5688)作為抗凝劑。

圖 3. 小鼠眼球取血后,評估量子點的生物相容性[7]

參考文獻及鳴謝
[1] Y. Song, Y. Wu, F. Ding, S. Li, Y. Shen, B. Yang, X. Tang, L. Ren, L. Deng, X. Jin, Y. Yan, The Preventive and Therapeutic Effects of Acute and Severe Inflammatory Disorders with Heparin and Heparinoid, Biomolecules 14(9) (2024).
[2] M. Poli, M. Asperti, P. Ruzzenenti, A. Naggi, P. Arosio, Non-Anticoagulant Heparins Are Hepcidin Antagonists for the Treatment of Anemia, Molecules 22(4) (2017).
[3] S.A. Mousa, In Vivo or Ex Vivo Models for Testing Thrombosis and Hemostasis, Drug Discovery and Evaluation: Pharmacological Assays2015, pp. 1-43.
[4] S. Momi, M. Nasimi, M. Colucci, G.G. Nenci, P. Gresele, Low molecular weight heparins prevent thrombin-induced thrombo-embolism in mice despite low anti-thrombin activity. Evidence that the inhibition of feed-back activation of thrombin generation confers safety advantages over direct thrombin inhibition, Haematologica 86(3) (2001) 297-302.
[5] L. Zhan, I. Yang, B. Kong, J. Shen, L. Gorczyca, N. Memon, B.T. Buckley, G.L. Guo, Dysregulation of bile acid homeostasis in parenteral nutrition mouse model, Am J Physiol Gastrointest Liver Physiol 310(2) (2016) G93-g102.
[6] W. Zhou, J. Hong, J. Han, F. Cai, Q. Tang, Q. Yu, G. Li, S. Ma, X. Liu, S. Huo, K. Chen, F. Zhu, Silkworm glycosaminoglycans bind to Bombyx mori nuclear polyhedrosis virus and facilitate its entry, Int J Biol Macromol 253(Pt 6) (2023) 127352.
[7] X. Tian, A. Zeng, Z. Liu, C. Zheng, Y. Wei, P. Yang, M. Zhang, F. Yang, F. Xie, Carbon Quantum Dots: In vitro and in vivo Studies on Biocompatibility and Biointeractions for Optical Imaging, Int J Nanomedicine 15 (2020) 6519-6529.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





