小鼠膽汁酸分析研究肝膽汁淤積病因
摘要
膽汁是肝臟分泌的一種重要物質,它有助于在腸道中消化食物中的脂肪。膽汁酸(BAs)是膽汁的主要有機溶質成分。這些膽汁酸由肝臟中的膽固醇合成,并儲存在膽囊中。當膽汁酸分泌到十二指腸區域后,在遠端小腸(回腸)中被重新吸收,并通過門靜脈循環返回肝臟。在腸道中,膽汁酸會被腸道細菌產生的膽鹽水解酶去結合(即去除甘氨酸或牛磺酸部分)。
膽汁酸被分為兩大類:主要膽汁酸(如膽酸-CA、熊去氧膽酸-CDCA)和次要膽汁酸(如脫氧膽酸-DCA、石膽酸-LCA)。1主要膽汁酸由肝細胞合成,而次要膽汁酸則是通過腸道細菌對主要膽汁酸的代謝作用生成。人肝臟主要合成初級膽汁酸CA和CDCA,小鼠主要從CDCA合成CA和6-羥基化鼠膽酸(MCA)。3種膽汁酸可進一步分為非結合型和結合型(如甘氨膽酸-GCA、牛磺膽酸-TLCA)組(結構總結見圖1)
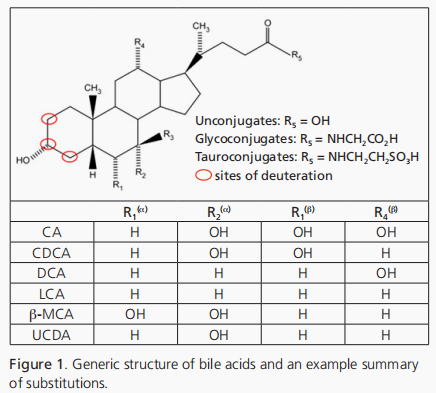

膽汁酸(BAs)調控多種重要的生物功能,包括脂質和葡萄糖代謝、營養物質的消化與吸收、體溫調節、能量平衡、膽汁酸合成及膽固醇平衡。許多疾病源于膽汁酸失衡,如膽汁酸腹瀉(或吸收不良)、膽汁酸合成障礙以及多種肝內膽汁淤積癥。幸運的是,膽汁酸療法正逐漸成為治療非酒精性脂肪肝、原發性膽汁性膽管炎和代謝綜合征(包括高血糖、高甘油三酯血癥、胰島素抵抗和肥胖)的治療選擇。
鑒于膽酸(BAs)在生物和功能上的重要性,其在組織(如肝臟、腸道、糞便)和生物流體(如尿液、血液)中的水平正逐漸被研究作為肝功能、損傷和疾病的潛在生物標志物。在這些研究中,通常使用質譜(MS)方法結合相應的穩定同位素標記標準品來量化游離和結合的膽酸。一種常用的方法是將反相液相色譜(RPLC)與質譜儀聯用,采用負離子模式下的多反應監測(MRM)或選擇反應監測(SRM)進行數據采集。然而,分析技術的發展受到了膽酸化學相似性(異構體和等重異構體)及其在生物基質中濃度范圍廣泛(從納摩爾到毫摩爾)等多方面因素的挑戰。
本文介紹了新開發的使用CIL膽酸標準混合物的方法,并討論了該方法在肝病研究中的應用結果。該方法解決了先前分析中遇到的一些難題,成功實現了對所有16種膽酸目標的基線分離。在研究應用中,通過使用肌球蛋白Vb(myoVb;基因MYO5B)缺失的動物模型,研究了遠端回腸和肝臟中膽汁酸組成的改變(見圖2)。
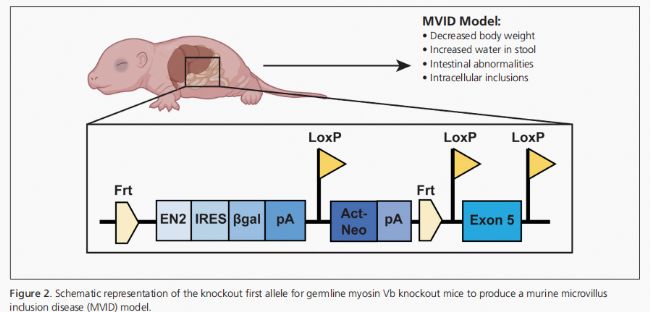 MyoVb是一種分子馬達,負責將關鍵物質運輸到上皮細胞的頂端膜。10個影響MyoVb功能的突變會導致人類出現微絨毛包含病(MVID),這種疾病會引起危及生命的腹瀉。11,12 MVID患者常伴有肝膽汁淤積癥,這是一種由于膽汁流動減少或受阻引起的疾病。13,14目前尚不清楚肝膽汁淤積癥和功能性MyoVb缺失時膽汁酸組成變化的原因,因此本研究旨在通過調查這些因素來增進對這一機制的理解。
MyoVb是一種分子馬達,負責將關鍵物質運輸到上皮細胞的頂端膜。10個影響MyoVb功能的突變會導致人類出現微絨毛包含病(MVID),這種疾病會引起危及生命的腹瀉。11,12 MVID患者常伴有肝膽汁淤積癥,這是一種由于膽汁流動減少或受阻引起的疾病。13,14目前尚不清楚肝膽汁淤積癥和功能性MyoVb缺失時膽汁酸組成變化的原因,因此本研究旨在通過調查這些因素來增進對這一機制的理解。
材料與方法
化學品與試劑
所有試劑均為最高可用等級,溶劑為LC-MS級。在儲存這些化學品和試劑時,遵循制造商的建議。CIL的穩定同位素標記膽酸混合物(未結合型,貨號MSK-BA1;結合型,貨號MSK-BA2)用作內標(IS)。CIL的未標記膽酸混合物(未結合型,貨號MSK-BA1-US;結合型,貨號MSK-BA2-US)用作真實參考材料。這些混合物用于特定化合物的質譜儀優化及校準標準品的制備。所有混合物均在-80°C(避光)下以純品和溶液形式儲存,直至使用。
溶液制備:將干燥的D-標記BA IS混合物分別溶解于1毫升甲醇與水(1:1,體積比)中,隨后進行幾分鐘的渦旋混合。這樣可以得到濃度~100微摩爾的IS儲備液。接著,將每份IS儲備液的等分試樣稀釋至250納摩爾,置于含有50毫升甲醇與水(1:1,體積比)的單個玻璃瓶中。這種IS工作溶液被標記為溶液A,并用于生物樣品提取物的制備。另一種IS工作溶液,稱為溶液B(用于中間和校準標準品的制備),通過將9毫升溶液A與1毫升甲醇與水(1:1,體積比)在玻璃瓶中稀釋制備,其濃度為225納摩爾。
類似于D標記的BA IS溶液制備方法,每個未標記的BA混合物分別溶解在1毫升甲醇與水(1:1,體積比)的混合液中,隨后進行幾分鐘的渦旋混合。這樣可以得到濃度~100微摩爾的清晰分析物儲備溶液。通過將每種未標記分析物儲備溶液的0.1毫升稀釋到含有0.8毫升溶液B的玻璃瓶中,并進行短暫的渦旋混合,制備了濃度為10微摩爾的中間溶液。溶液B作為制備校準標準品的稀釋劑(見表1)。
 小鼠MVID模型用于研究肝膽汁淤積。最近,研究人員開發并研究了缺乏myoVb的生殖系小鼠(KO小鼠),以了解myoVb缺失對腸上皮的影響。新生的生殖系myoVb KO小鼠表現出多種腸道異常,包括細胞內微絨毛內含物、絨毛融合、過度增殖、極性蛋白變化和頂端轉運蛋白缺陷。此外,這些小鼠的生長速度比同窩對照小鼠慢,并且大約在出生后3-7天因脫水而死亡。盡管腸道在myoVb KO小鼠中已得到充分研究,但肝臟生理變化尚未被記錄,盡管新的研究表明myoVb突變與肝膽汁淤積有關。我們使用之前描述的myoVb KO小鼠來研究myoVb缺失對肝臟和腸道膽汁酸調節的影響。我們的數據表明,生殖系myoVb KO小鼠不僅可能作為人類疾病腸道模型,也可能作為肝膽汁淤積的肝臟模型。
小鼠MVID模型用于研究肝膽汁淤積。最近,研究人員開發并研究了缺乏myoVb的生殖系小鼠(KO小鼠),以了解myoVb缺失對腸上皮的影響。新生的生殖系myoVb KO小鼠表現出多種腸道異常,包括細胞內微絨毛內含物、絨毛融合、過度增殖、極性蛋白變化和頂端轉運蛋白缺陷。此外,這些小鼠的生長速度比同窩對照小鼠慢,并且大約在出生后3-7天因脫水而死亡。盡管腸道在myoVb KO小鼠中已得到充分研究,但肝臟生理變化尚未被記錄,盡管新的研究表明myoVb突變與肝膽汁淤積有關。我們使用之前描述的myoVb KO小鼠來研究myoVb缺失對肝臟和腸道膽汁酸調節的影響。我們的數據表明,生殖系myoVb KO小鼠不僅可能作為人類疾病腸道模型,也可能作為肝膽汁淤積的肝臟模型。
組織收集與均質化
新生小鼠(每組3只,包括敲除組和對照組)在年齡較小的情況下,通過二氧化碳安樂死并隨后斷頭。此程序遵循了MUSC批準的IACUC協議(編號#2021-01252)。在小鼠腹部切開后,取出肝臟和回腸。每個組織樣本的質量被稱重,并放入含有0.1克1.4毫米陶瓷珠(MP Biomedical產品編號116540434)的組織均質化管中。向每個含有組織樣本的試管中加入等同于200 mg/mL組織密度的冰凍甲醇。使用BeadBug組織均質器(或類似設備)在4 m/s下進行兩次均質化處理,每次20秒。均質后的組織碎片通過在室溫下以16,000×g離心5分鐘來沉淀,然后將上清液轉移至新的2.0 mL冷凍管中。這些樣本在-80°C下保存,直至進行LC-MS/MS分析。
LC-MS/MS樣品制備
在分析時,將組織樣本從-80°C的冷凍環境中取出,并在實驗室臺面上逐漸升溫至室溫。使用300微升的玻璃自動進樣器HPLC容器(13毫米內徑,帶微插件;賽默飛世爾科技),將每份甲醇化、均質化的組織樣本10微升的體積稀釋在90微升的溶液A(即標記的內標物)中。隨后,蓋上自動進樣器瓶蓋,并進行短暫的渦旋混合。此外,還放置了條件標準品(Cond Cal A,所有BAs的濃度為2.44納摩爾)、試劑空白(RBlk)樣品(即溶劑)、空白內標物樣品(Blk-IS,濃度為0納摩爾校準物)、校準物(每個A至F水平n=3次注射,例如Cal A),以及混合質量控制(QC)標準品(例如,用于混合回腸QC的pooled IlQC)。Shimadzu Nexera SIL-30ACMP自動進樣器配備了1.5毫升聚丙烯瓶架(每個瓶架有54個瓶位),以容納上述指定的玻璃自動進樣器容器。所有樣品均在柱上注入15微升,進行LC-MS/MS分析。
RPLC系統條件和梯度程序
BAs的LC分離在Raptor C18柱(100×2.1 mm內徑,2.7μm;Restek)和Ultra C18保護柱(10 x 2.1 mm內徑,5μm;Restek)上進行。在整個運行過程中,柱和樣品盤分別保持在50°C和4°C。在15微升的柱上注射后,分析物在17分鐘的梯度(見表2)中以0.3毫升/分鐘的流速分離。流動相的組成如下:
洗脫液A:10 mM甲酸銨水溶液;洗脫液B:乙腈

MS/MS描述及采集方法參數
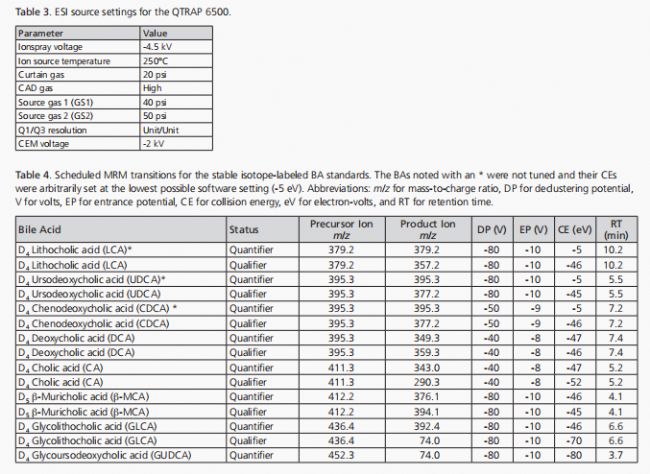
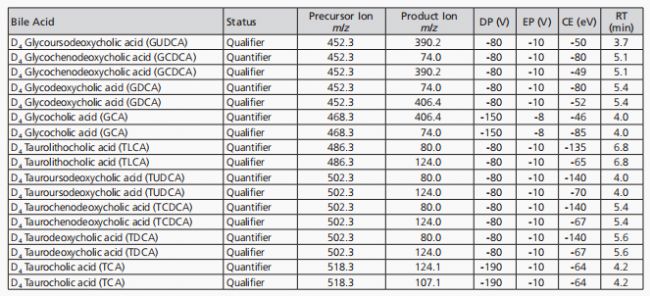
LC-MS/MS平臺由一臺Shimadzu(日本京都)的Nexera-XR MP UHPLC系統和一臺SCIEX(美國馬薩諸塞州弗雷明漢)的QTRAP®6500質譜儀組成,使用上述描述的保護柱和分析柱。TurboIonSpray®(電噴霧電離源)探針安裝在IonDrive™Turbo V離子源中,該離子源以負離子模式運行。表3列出了本方法中使用的全局MS儀器參數,而表4則列出了穩定同位素標記標準品的預定MRM(單分子多反應監測)采集的分子特異性參數。除非另有說明,分子特異性參數是通過注入純BA溶液(濃度為1微克/毫升,甲醇:水1:1,體積比)來經驗性調整的。對于標記和未標記的標準品,每個BA監測兩個躍遷,總計64個MRM躍遷。由于實施了sMRM掃描,每個MRM躍遷的占空比和駐留時間是動態的,并由采集軟件(Analyst®,版本1.6.2;SCIEX)控制。
 分析數據
分析數據
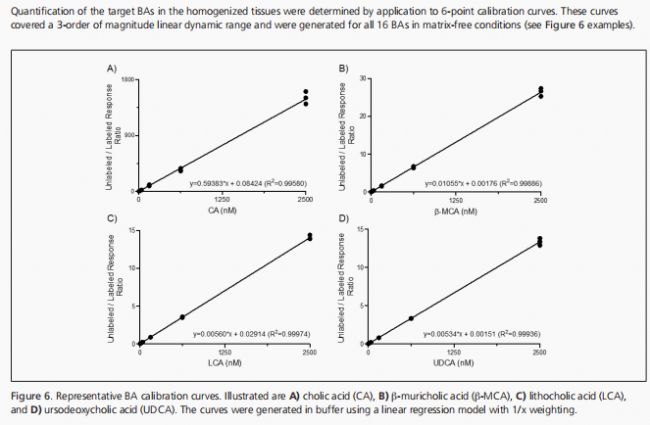
LC-MS/MS系統的操作控制使用了Analyst®(版本1.6.2),數據分析則在MultiQuant™(版本3.0.1;SCIEX)和Microsoft Excel中完成。在結果解釋前,通過手動檢查目標BAs的峰選擇和積分來驗證。對于所有16種BAs,構建了無基質的校準曲線(從A點2.44 nM到F點2.5µM,每個點有3次注射),校準曲線采用1/x加權因子,通過繪制每個校準物的測量響應比(未標記/標記)與制備濃度的關系圖來構建。BA內標用于標準化內源性BA化合物,樣品提取物中均質組織的質量被納入濃度測定計算中。BA的濃度以每克勻漿組織中的納米摩爾數表示。在生成熱圖之前,每個BA的標準化組織濃度在所有樣本中進行了十分位數縮放。具體來說,最低和最高的濃度值分別被設定為0和1,而中間的每個值則根據這一標準進行縮放。熱圖是使用開源數據分析和可視化軟件包Orange(版本3.29.1)生成的。
結果和討論方法
開發和BA定量
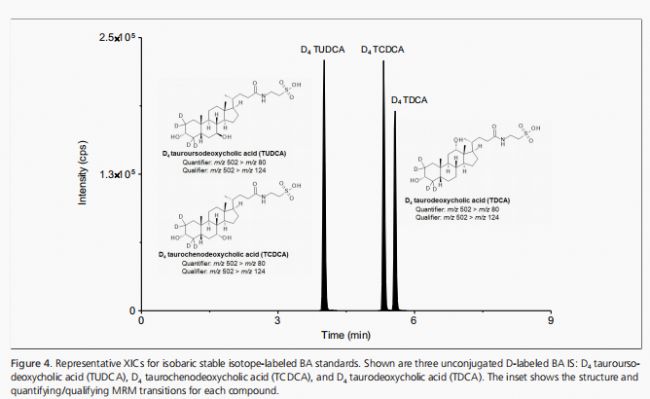
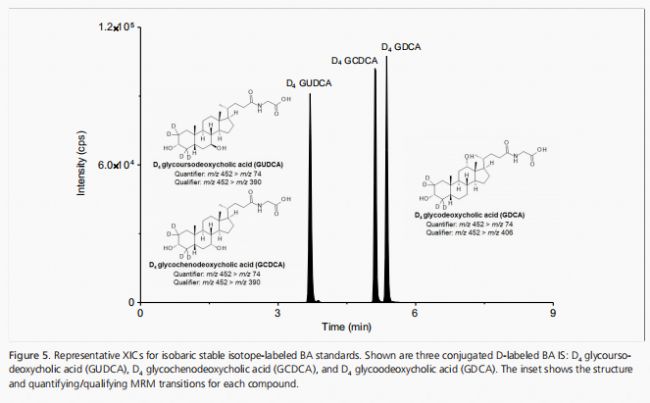
針對16種目標BAs的sMRM躍遷,其分子特異性參數在QTRAP 6500上通過實驗優化。對于非等重BAs(如CA、DCA、LCA、TCA、TLCA、GCA和GLCA),通過將含有所有BAs的混合中間溶液以1µg/mL的濃度注入甲醇-水(1:1,v/v)中進行10倍稀釋來實現優化。對于具有共同前體和/或產物離子的等重BAs,使用單獨調諧溶液進行優化,這些溶液以1µg/mL的濃度制備,溶劑為1:1的甲醇-水(分別對應β-MCA、CIL產品編號DLM-10626;CDCA、CIL產品編號DLM-6780;UDCA、CIL產品編號DLM-9574;TCDCA、CIL產品編號DLM-9562;TUDCA、CIL產品編號DLM-9882;TDCA、CIL產品編號DLM-9568;GCDCA、CIL產品編號DLM-7804;GUDCA、CIL產品編號DLM-9558;GDCA、CIL產品編號DLM-9554)。通過輕微調整先前優化的梯度程序,我們的最終方法能夠提供所有BAs的基線分辨率。例如,可以觀察到等重TUDCA、TCDCA和TDCA BAs(見圖4)以及GUDCA、GCDCA和GDCA(見圖5)的基線分離。
 這些批次中包含了系統適用性、殘留量和合并的質控測量(質控數據未顯示)。這些措施旨在評估方法性能。系統適用性測試通過三次注射最低校準標準品(Cal A;2.44 nM,用于BAs)進行。隨后,對三次Cal A注射中測量到的每個BAs峰進行了積分,并計算了精度(%CV)。表5展示了我們典型的系統適用性精度結果。
這些批次中包含了系統適用性、殘留量和合并的質控測量(質控數據未顯示)。這些措施旨在評估方法性能。系統適用性測試通過三次注射最低校準標準品(Cal A;2.44 nM,用于BAs)進行。隨后,對三次Cal A注射中測量到的每個BAs峰進行了積分,并計算了精度(%CV)。表5展示了我們典型的系統適用性精度結果。
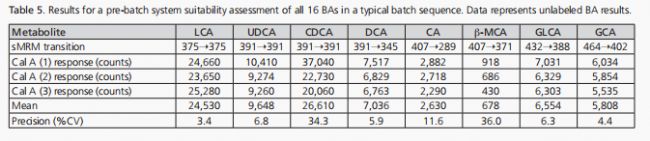
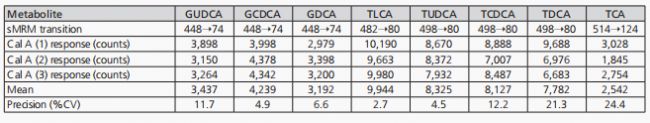 系統適用性試驗中發現的高精密度為分析系統適用于實驗樣品分析提供了信心。
系統適用性試驗中發現的高精密度為分析系統適用于實驗樣品分析提供了信心。
在殘留評估中,計算了序列批次中未標記和D-標記BA響應(峰面積)的比例,這些響應是在第三次Cal H(所有BAs均為2,500 nM)后注入的空白樣品中測得的,與三次Cal A注射中的平均未標記和D-標記BA響應相比。殘留以百分比形式表示,未標記BAs的典型殘留結果見表6,D-標記BA IS化合物的殘留結果見表7。
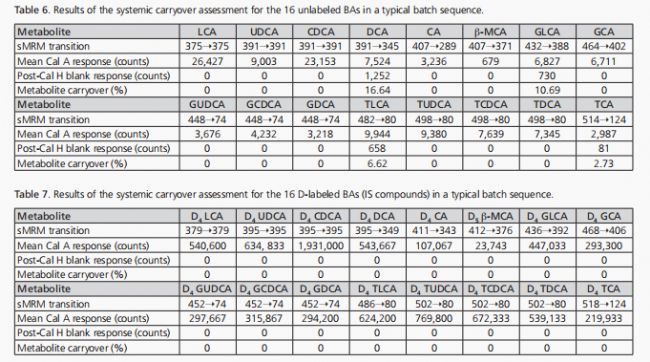 研究結果
研究結果
顯示,未標記的BA分析物和D-標記的IS化合物的殘留量幾乎可以忽略不計,其精度甚至達到了FDA-GLP的要求(即,未標記分析物的殘留量低于20%,IS化合物的殘留量低于5%)。這進一步證明了所開發方法的有效性和分析平臺的可靠性。
研究結果表明,體內肌動蛋白Vβ(myoVb)的缺失會導致多種腸道功能障礙。然而,肌動蛋白Vβ在其他器官系統中的作用及其對膽汁酸(BAs)調節的影響尚不明確。我們測量了同窩對照組和肌動蛋白Vβ基因敲除小鼠的膽汁酸組成,以確定這些變化是否由遠端腸道和肝臟中肌動蛋白Vβ功能喪失引起。
種系myoVb KO小鼠的肝臟中CA、DCA、β-MCA、GCA、TUDCA、TCDCA和TCA水平顯著降低(見圖8)
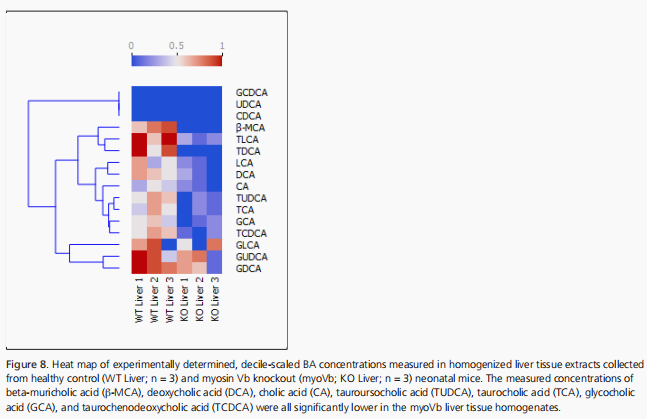 這些數據表明,myoVb的缺失可能影響BA信號傳導或BA的組裝。在回腸中測量BA時發現,與同窩對照組相比,myoVb基因敲除小鼠的CA和β-MCA水平顯著升高(見圖9)。
這些數據表明,myoVb的缺失可能影響BA信號傳導或BA的組裝。在回腸中測量BA時發現,與同窩對照組相比,myoVb基因敲除小鼠的CA和β-MCA水平顯著升高(見圖9)。
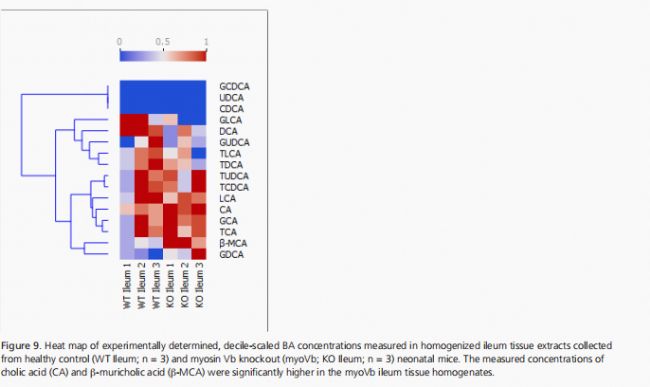
這表明,myoVb的缺失可能會阻止BAs從腸細胞正確運輸到肝循環,從而將BAs送回肝臟進行循環。
總體而言,同窩對照組與myoVb基因敲除小鼠之間膽汁酸(BAs)組成的差異表明,myoVb的缺失影響了肝臟和腸道中膽汁酸的正常生成和循環。此外,這也提示myoVb可能在肝臟和腸道中調節膽汁酸信號通路(即FXR途徑)。
結論和展望
開發的LC-MRM/MS方法提供了一種新的手段,能夠以高通量的方式基線分離多種膽汁酸(BAs),其中一些膽汁酸具有同量異位物。在實際應用中,該方法揭示了關于體內肌球蛋白Vb丟失的幾個有趣發現。結果顯示,肝臟中的CA、DCA、β-MCA、GCA、TUDCA、TCDCA和TCA顯著減少。值得注意的是,在肌球蛋白Vb敲除的小鼠中,回腸組織中的CA和β-MCA含量高于同窩對照組。這些數據表明,小鼠肝臟和胃腸道組織樣本中膽汁酸的測量結果,提示功能性肌球蛋白Vb的缺失可能影響了肝臟膽汁酸的產生或分泌。下一步,我們將分析缺乏肝細胞肌球蛋白Vb的成年小鼠體內產生的膽汁酸組合。我們還計劃將此方法擴展到新生兒和成年小鼠的膽汁淤積性肝病模型中,以測量循環膽汁酸的水平。總的來說,能夠準確測量實驗模型中個別膽汁酸的方法,如本研究所開發的方法,是深入了解復雜膽汁酸作用機制的關鍵工具。





