心肌缺氧應激介導功能性心臟細胞外囊泡釋放機制及其臨床意義
細胞外囊泡的生物學特性與分類
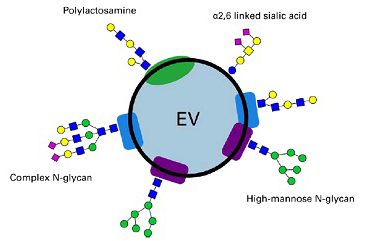
細胞外囊泡(EVs)是由脂質雙層膜包裹的非復制性顆粒,源自多種亞細胞結構。根據物理特征可將其分為:小EVs(<100-200nm)和中/大EVs(>200nm);根據細胞來源或釋放條件可分為:血小板EVs、缺氧EVs或凋亡小體等。EVs表面攜帶來源細胞的特異性抗原,同時富含磷脂酰絲氨酸(PS)和乳粘素等膜蛋白。作為細胞間通訊的重要媒介,EVs通過攜帶蛋白質、mRNA、miRNA和脂質等活性分子調控微環境。研究表明,鞘脂類物質(如神經酰胺Cer和1-磷酸鞘氨醇)在EVs的生物發生、釋放及功能調控中發揮關鍵作用。
心臟特異性EVs的標志物發現
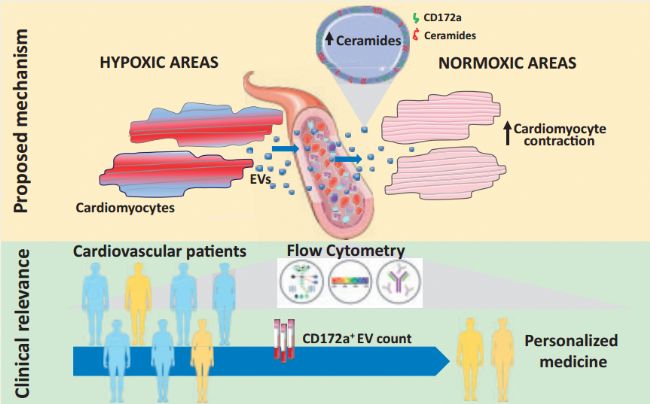
意大利和德國聯合團隊在《European Heart Journal》(IF=22.673)發表的重要研究,首次報道CD172a(SIRPα)可作為心肌源性EVs的特異性表面標志物。該發現突破了既往因心肌細胞特異性表面抗原缺乏導致的心臟EVs檢測瓶頸。CD172a原本在單核細胞和淋巴細胞中表達,但研究者通過人類誘導多能干細胞(hiPSCs)分化模型,證實其可特異性標記心肌譜系細胞及其釋放的EVs。

缺氧應激促進功能性EVs釋放
研究發現,心肌細胞在缺氧應激狀態下CD172a+ EVs釋放顯著增加。體外和體內實驗均證實,缺氧條件下:1)心肌細胞EVs分泌量上升;2)這些EVs表面神經酰胺含量明顯增高。功能學實驗顯示,從缺氧處理的hiPSCs-CMs培養上清中分離的EVs,能誘導未應激心肌細胞產生正性肌力效應,該作用依賴于EVs表面神經酰胺的表達水平。這表明心臟通過釋放EVs實現應激區域與非應激區域的功能協同。
在心血管疾病中的臨床價值
研究團隊檢測了主動脈瓣狹窄、缺血性心臟病和心肌病患者的循環EVs,發現其CD172a+ EVs水平均顯著高于健康人群,且與疾病進程相關。特別在主動脈瓣狹窄(引發心肌肥厚和缺氧的老年性疾病)患者中:接受經導管主動脈瓣置換術(TAVR)的患者,術前循環CD172a+ EVs高水平組生存率顯著優于低水平組。Kaplan-Meier曲線證實CD172a+ EVs可作為TAVR預后的獨立預測指標。這為心血管疾病提供了新型預后生物標志物。
研究意義與轉化前景
該研究具有雙重突破性:1.首次建立CD172a標記的心肌EVs檢測體系,解決來源鑒定難題;2.揭示缺氧應激下EVs通過神經酰胺介導心臟功能代償的新機制。
臨床轉化方面,循環CD172a+ EVs檢測有望用于:1.心血管疾病風險分層;2.治療反應監測;3.預后評估。
未來研究可探索:1.EVs攜帶的具體活性分子;2.神經酰胺信號通路的精準調控;3.基于EVs的心臟保護療法開發。
這些發現為心血管疾病的精準診療開辟了新途徑。
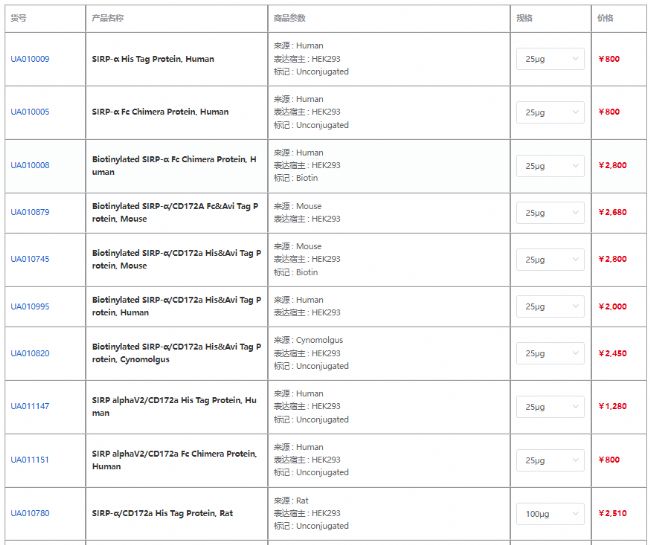
產品信息
參考文獻
AnselmoA, et al. Myocardial hypoxic stress mediates functional cardiacextracellular vesicle release. Eur Heart J. 2021 Jun9:ehab247. PMID: 34104945.
杭州斯達特 (www.starter-bio.com)志在為全球生命科學行業提供優質的抗體、蛋白、試劑盒等產品及研發服務。依托多個開發平臺:重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發平臺(E.coli,CHO,HEK293,InsectCells),已正式通過歐盟98/79/EC認證、ISO9001認證、ISO13485。