通過SMARTSeq單細胞試劑盒的MANTIS進行384孔板1/4體積反應cDNA合成
本實驗步驟描述了在MANTIS®液體處理器上使用SMART-Seq單細胞試劑盒(SSsc kit, Cat. # 634472)進行 四分之一體積的反應,從384孔板的單細胞中生成cDNA。
II. 概論
-
使用SSsc試劑盒進行384次反應,精確計算如下試劑體積,為了確保有足夠的試劑進行384次四分之一 體積的反應,請務必遵守LV、HV芯片的灌注和預分配體積。
- LV芯片灌注體積= 5.4 μl
- LV芯片預分配體積為=1.2 μl
- HV芯片灌注體積=12 μl
- HV芯片預分配體積=5 μl
-
每一個新的添加物使用一個新的芯片。在一天運行結束后,按照相應的洗滌步驟清洗所有LV和HV芯 片。
-
注意避免在整個過程中出現氣泡。
-
有關SMART-Seq單細胞套件的更多信息,請參閱SMART-Seq單細胞套件用戶手冊。
III. 實驗步驟
A. 用于細胞分選的384孔板的制備
1. 為了制作CDS分選溶液(CSS),首先手動注入114μl 10X裂解緩沖液到1.5 ml無核酸酶管中。
2. 添加6μl核糖核酸酶抑制劑(40 U /μl),通過緩慢混合后快速旋轉試劑。
3. 將120μl的3’SMART-Seq CDS Primer II A加入到10X反應緩沖液中(總體積為60μl)。
4. 加1,260μl無核酸酶水(總體積1,500μl)。
5. 緩慢旋轉混合物。
6. 將750μl的CSS注入兩個1000μl的吸管剪短,并將尖端裝入LVMANTIS芯片(位置1和2)。通過對 MANTIS液體處理器編寫程序,從選擇的位置添加3.2μl CSS到每個孔中。
注:在本實驗方案中,我們假設FACS對細胞的分選不會改變板孔中液體的體積。如果分選機分配了不可忽略體積的鞘液 量,可通過減少無核酸酶水的量來調整CSS混合物的體積,使其總體積保持在3.2μl /孔。
安全停止點:孔板可在-20°C保存過夜。
B. 細胞分類
1. 將細胞直接注入含有CSS的板孔中。
2. 分類完成后,將孔板密封,并將其快速旋轉,使細胞到達孔的底部。
3. 立即將孔板放置于干冰上約5分鐘,然后轉移到-80°C的冰箱。
安全停止點:孔板可在-80°C保存過夜。
C. 低聚糖退火
1. 從-80°C的冰箱中取出孔板,讓它解凍約1分鐘,并輕微旋轉。然后,向下旋轉孔板,收集孔底的 內容物。
2. 將孔板轉移到預熱過的熱循環器中,在72°C孵化3分鐘。
3. 孵化3分鐘后,放置到冰塊上2分鐘。
4. 當孔板放在冰上時,準備RT反應混合液(D部分)。
D. RT反應混合液的制備
1. 將下列試劑按如下順序室溫添加到1.5 ml無核酸酶管中,制備足夠的RT反應混合物,進行384次 反應。務必在使用前最后添加SMARTScribe™II逆轉錄酶,上下輕輕混合。
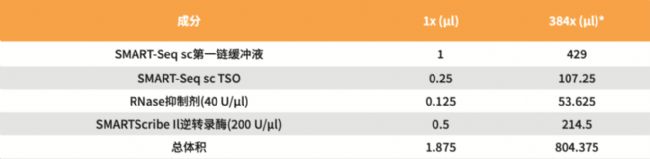
*該圖表詳細說明了每種成分進行384次反應所需的量(相當于一孔板的量),包括以計算移液誤差的補充體積。
2. 在1,000μl的移液管吸頭加入804μl的RT反應混合也,裝入LV MANTIS MANTIS液處理器編程,將1.9μl的RT反應混合液加入到選擇的孔中。
3. 用封口膠帶密封孔板,收集試劑,輕輕旋轉3-5次孔板。
4. 以每分鐘2000轉的速度旋轉孔板30-60秒。
E. 第一鏈的合成
1. 將孔板從D部分轉移到一個預熱的熱循環器中,并運行以下程序

2. 程序完成后,以每分鐘2000轉的速度旋轉平板30-60秒。
安全停止點:孔板可在4°C保存過夜。
F. PCR擴增cDNA
1. 將以下試劑按照順序加入到2.0 ml冰管中,準備足夠的384個反應的PCR反應混合液。請務必在 使用前最后添加SeqAmp™DNA聚合酶,上下輕輕混合。
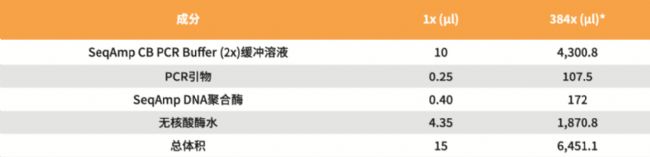
*該圖表詳細說明了每種成分進行384次反應所需的量(相當于一孔板的量),包括以計算移液誤差的補充體積。
2. 在6個1000μl的移液管吸頭加入1030μl PCR主混合液,將每個吸頭裝入HV MANTIS 芯片(位置 1-6)。每1000μl的移液器吸頭,使用MANTIS液體處理器編程,在E階段制備的孔板每孔中加入 15μl的PCR主混合液。
3. 用封口膠帶密封孔板,收集試劑,輕輕旋轉3-5次孔板。
4. 以每分鐘2000轉的速度旋轉孔板30-60秒。
5. 將孔板轉移到預熱過的熱循環器中,運行以下程序:
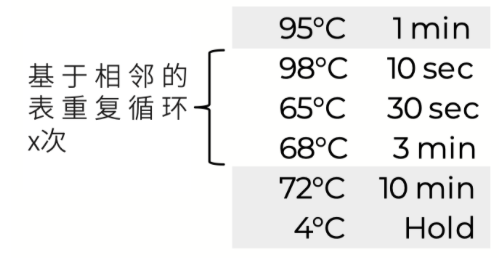
*使用以下表格作為指導,以幫助確定輸入的最佳PCR循環次數:
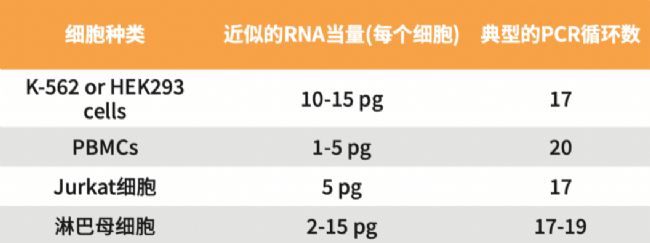
安全停止點:孔板可在4°C保存過夜。
G. 用NucleoMag NGS純化及片段選擇純化擴增的cDNA
cDNA可以通過NucleoMag NGS的純化及片段選擇(Takara Bio, 744970.5, 744970.50,或 744970.500)純化。
注:NucleoMag NGS的純化及片段選擇磁珠懸浮可以用等量的agcourt AMPure XP磁珠代替。
1. 每次使用前,取適量置于室溫下至少30分鐘,攪拌均勻即可。
2. 每次實驗準備新鮮的80%乙醇。每個樣品需要100μl。
3. 需要一個能容納384孔板的磁力分離架。
4. 將NucleoMag NGS的純化及片段選擇磁珠混合均勻,然后在每個樣品中加16μl。
5. 通過輕輕旋轉或上下搖晃移液至少10次,徹底混合。
6. 室溫孵化8分鐘,讓cDNA與磁珠結合。
7. 輕輕地旋轉樣品,從樣品孔的側面收集液體。將樣品放在磁力分離架上約5分鐘或更長時間,直 至液體完全清澈,上清液中無磁珠殘留。
8. 當樣品放在磁力分離架上時,用移液管移去上清液并丟棄。
9. 把樣品放在磁力分離架上。每個樣品添加50μl新鮮配制的80%乙醇,不干擾磁珠。等待30秒后, 小心移去含有污染物的上清液。在清洗過程中, cDNA將繼續結合在磁珠上。
10. 重復乙醇清洗(步驟9)一次。
11. 輕輕地旋轉樣品,從樣品孔的側面收集液體。將樣品放在磁力分離架上30秒,然后用吸管除去所 有剩余的乙醇。
12. 在室溫下放置樣品約2-2.5分鐘,直到顆粒不再有光澤,但在裂紋出現之前。
13. 待磁珠干燥后,加17μl的洗脫緩沖液蓋住磁珠。從磁力分離架中取出樣品,徹底混合,重新懸浮磁珠。
14. 室溫孵化2分鐘以補水。
15. 輕輕地旋轉樣品,從樣品孔的側面收集液體。將樣品放在磁力分離架上約1分鐘或更長時間,直 至液體完全清澈。
16. 將含有純化cDNA的上清液從每個孔轉移到無核酸酶,低粘附力的管中。在每個試管上貼上樣品 信息標簽,并在-20°C保存,直到庫準備好。
安全停止點:孔板可在-20°C保存過夜。
17. 參考SMART-Seq Single Cell Kit用戶手冊,了解量化和庫準備選項。
- Myra液體處理系統結合ADP-Glo™技術革新激酶檢測
- 使用MANTIS,通過Smart-seq3生成高質量的單細胞RNA-seq數據
- MANTIS®液體處理器用于單細胞質譜分析的SCoPE2樣品制備
- 使用SMART-Seq®單細胞試劑盒在MANTIS®液體處理器上合成cDNA
- 通過SMARTSeq單細胞試劑盒的MANTIS進行384孔板1/4體積反應cDNA合成
- 使用桌面微流體技術實現低輸入RNA-Seq樣品制備的自動化和小型化
- 磁感應qPCR儀Mic和Myra自動化液體處理系統助力“飛行獸醫”移動診斷
- 在MANTIS上用SMART-Seqv4低輸入RNA試劑盒構建cDNA1/4反應庫進行測序