藥品記錄與數據管理規范版本細節對比
《藥品記錄與數據管理規范(征求意見稿)》 | 第四版與第三版的對比
國家藥監局在2020年02月25號發布了《藥品記錄與數據管理規范(征求意見稿)》,這是關于數據管理規范的第四版的征求意見稿。全文分六個章節,共29個條款,整篇規范的文章結構如下(見圖1):

▲ 圖1
相對第三版征求意見稿《藥品數據管理規范(征求意見稿)》,第四版征求意見稿改動很大。
一、從文章的結構方面
《藥品記錄與數據管理規范(征求意見稿)》(圖二) 的主體內容是第二章到第五章:記錄與數據管理基本原則、紙質記錄管理要求、電子記錄管理要求和數據管理要求。
整篇文章圍繞者記錄與數據展開,就篇幅而言,在小編看來是偏重于記錄的管理。《藥品數據管理規范(征求意見稿)》(圖三)的主體內容也是第二章到第五章,分別是質量管理、人員、數據基本要求和系統。
整篇文章從對企業管理體系的要求,人員的要求(包括管理層),數據的基本要求和系統的要求(包括產生紙質記錄和電子數據的系統要求),文章的重點偏重于數據的基本要求,圍繞ALCOA原則展開具體的要求。

▲ 圖2 ▲ 圖3
二、從文章的內容方面
就范圍而言,《藥品記錄與數據管理規范(征求意見稿)》說的是“藥品研制、生產、經營和使用活動中產生的依法需要向藥品監督管理部門提供的記錄與數據”;《藥品數據管理規范(征求意見稿)》說的是“藥品研發、生產、流通、上市后監測與評價等產品生命周期中全部活動的數據管理”。
《藥品記錄與數據管理規范(征求意見稿)》中的第二章節和第三章節中與記錄有關的內容都是新加的內容。第三章紙質記錄管理中的內容是可以參考《藥品生產質量管理規范》中第八章節文件管理。
《藥品記錄與數據管理規范(征求意見稿)》中相對于第三版,基本刪除了對于風險管理和管理層責任的要求。
《藥品記錄與數據管理規范(征求意見稿)》的第四章電子記錄管理要求(圖三),其內容和《藥品數據管理規范(征求意見稿)》中的第五章系統(圖四)的內容相似,但是沒有提到審計追蹤和數據安全。
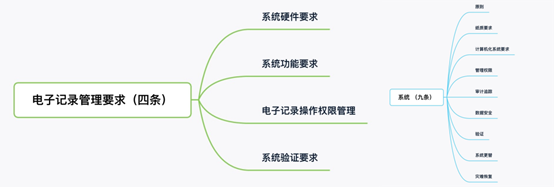
▲ 圖 4 ▲ 圖 5
《藥品記錄與數據管理規范(征求意見稿)》的第五章數據管理要求。只是對不同類型的數據的要求,沒有像《藥品數據管理規范(征求意見稿)》中第四章數據基本要求那樣,從ALCOA原則的各個內容進行展開要求。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





