利用多維供體工程構建NIR-II AIE聚集體實現原位乳腺癌多模式光療
本文要點:集多種光診斷與光治療功能于一體的“一體化”多模態光診療劑已成為推進癌癥治療的新型平臺。本文首次提出多維供體工程策略,在分子結構、聚集體態及溶劑相互作用層面協同優化供體設計,成功構建D-A-D型NIR-II聚集誘導發光分子(AIEgen)OPITBT。其納米顆粒(OPITBT NPs)在四氫呋喃中的熒光量子產率提升16倍,兼具優異光熱轉換效率(PCE)與I型活性氧(ROS)生成能力。進一步構建的腫瘤靶向納米粒(OPITBT-R NPs)可在單束808nm激光激發下,通過熒光-光聲-光熱多模態成像引導的光動力-光熱協同治療徹底清除原位乳腺癌。值得注意的是,該制劑依靠卓越的NIR-II熒光亮度實現了活體小鼠全身血管的NIR-IIb高分辨成像。本工作為平衡光診療性能提供了增強NIR-II熒光分子輻射耗散的普適性策略,推動了一體化光診療系統的發展。
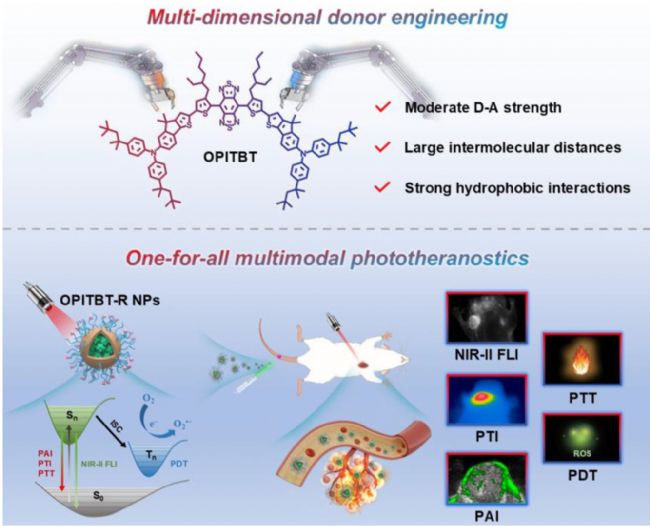
本研究提出創新的多維供體工程策略,通過同步調控分子結構、聚集體態及溶劑相互作用三個維度優化NIR-II聚集誘導發光分子(AIEgens)性能:(i) 通過供體工程調節給體-受體(D-A)作用強度,獲得適配能帶隙,平衡吸收/發射波長與固有非輻射能量耗散;適度D-A強度還可抑制分子扭曲電荷轉移(TICT)效應;(ii) 通過供體工程控制分子構象,改變聚集體中的分子堆疊模式,從而增強AIE特性并提升熒光量子產率;(iii) 引入體積龐大的疏水基團可最小化AIEgens與水分子相互作用,且聚集態形成的致密疏水網絡進一步增強疏水作用,最終顯著提高熒光量子產率。
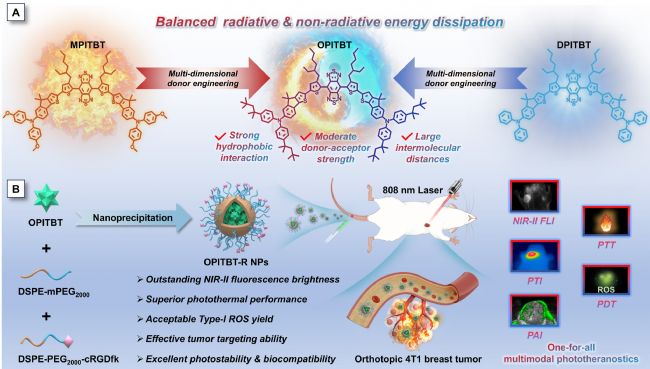
方案1.(A)具有多模光療性能的NIR-II AIEgens供體工程示意圖。(B)OPITBT-R NPs的納米制備及其在NIR-II FLI/PAI/PTI三峰成像引導PDT/PTT中的應用(Figdraw)
作為概念驗證,本文設計并合成新型強供體單元——二苯胺茚并[1,2-b]噻吩,通過引入甲氧基與2,4,4-三甲基戊烷-2-基團調控其性能。將三種不同供體單元與噻吩苯并噻二唑偶聯,成功開發出三種新型D-A-D型NIR-II聚集誘導發光分子(方案1A)。通過系統實驗研究,在分子及納米聚集體層面全面評估了它們的光物理性質,包括吸收/發射波長、AIE特性、熒光量子產率、活性氧生成能力及光熱轉換效率。其中代表性OPITBT納米顆粒展現出卓越的光穩定性、高NIR-II熒光亮度、優異光熱性能和可接受的活性氧生成能力,彰顯了多模態光診療應用的巨大潛力。這些實驗結果證實了多維供體工程策略在平衡激發態能量耗散路徑方面的有效性。通過理論計算進一步闡明了該策略的可行性機制。基于DSPE-PEG2000-cRGDfk修飾構建的腫瘤靶向納米粒OPITBT-R,在808nm近紅外激光激發下,通過NIR-II熒光/光聲/光熱三模態成像引導的光動力-光熱協同治療,實現了原位乳腺癌的有效根除(方案1B)。本研究既彰顯了多維供體工程的成功實踐,又為開發多功能"一體化"診療劑提供了系統設計指南。
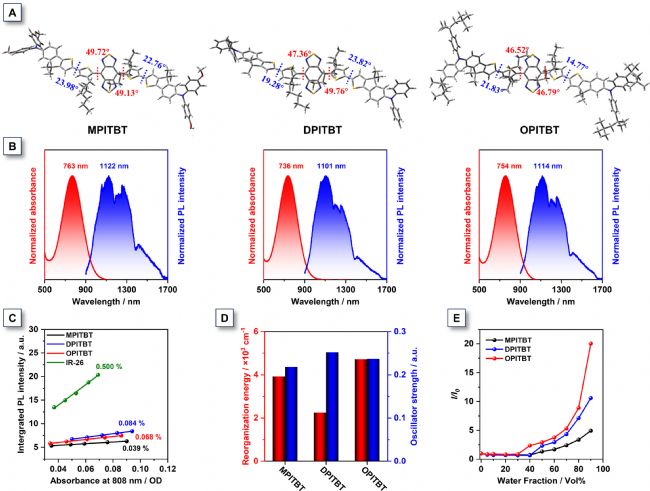
圖1. MPITBT、DPITBT和OPITBT的結構和光譜
通過密度泛函理論(DFT)在B3LYP/6-31G(d,p)基組水平對MPITBT、DPITBT和OPITBT基態(S₀)的優化幾何構型及前線分子軌道進行了計算。如圖1A所示,三種分子具有相似骨架:苯并雙噻二唑核心與噻吩單元間存在大二面角(>45°),有效抑制了聚集態分子間π-π堆疊。烷基化噻吩單元與茚并噻吩單元的二面角顯著減小至約20°,表明茚并噻吩的引入緩解了分子骨架扭曲,從而增強共軛程度與光吸收能力。三者的LUMO能級相近,HOMO能級則隨供體強度變化,最終形成1.13、1.27和1.21 eV的窄帶隙,預示其在近紅外一區(NIR-I)具有強吸收潛力。對應在四氫呋喃溶液中的吸收峰分別位于763、736和754 nm,摩爾消光系數達1.80×10⁴、1.83×10⁴和1.93×10⁴ M⁻¹cm⁻¹(圖1B)。鑒于808 nm是NIR-I區最優激發波長,計算顯示三者在該波長仍保持10⁴ M⁻¹cm⁻¹量級的消光系數,表明其適用于808 nm激光激發的多模態光診療(圖S18)。此外,這些分子在THF中展現900-1700 nm的寬譜發射,最大發射峰位于1100 nm附近,具備優異NIR-II熒光成像潛力(圖1B)。超過350 nm的顯著斯托克斯位移可有效規避自吸收效應。隨著溶劑極性增強,三者的發射峰明顯紅移且熒光猝滅,呈現典型的扭曲分子內電荷轉移(TICT)特性。以IR-26(在1,2-二氯乙烷中量子產率QY=0.5%)為參照,測得三種分子在四氫呋喃中的NIR-II熒光QY極低,分別為0.084%、0.068%和0.039%(圖1C)。理論計算的振子強度與熒光量子產率變化趨勢一致(圖1D)。重組能(λ)計算表明,低頻區(波數<500 cm⁻¹)的二面角振動對總λ貢獻最大,主要反映分子扭轉變動與非輻射衰減。值得注意的是,OPITBT的λ值高達5896.41 cm⁻¹,其中二面角變化貢獻率達80%,顯著高于MPITBT和DPITBT(圖1D),這歸因于其外圍四個大位阻烷基鏈構成的高柔性分子結構。為驗證AIE特性,繼續研究了它們在四氫呋喃/水混合體系中隨含水量(fw)增加的熒光行為。當fw升至90%時,三者均呈現不同程度熒光增強,其中OPITBT熒光強度較0%含水量狀態增強21倍,展現出典型AIE特性(圖1E)。隨fw增加,溶液顏色顯著變化,其在50%和90%含水量下的吸收光譜顯示:吸收峰分別紅移49 nm(MPITBT)、43 nm(DPITBT)和51 nm(OPITBT),顯著提升了長波長區的摩爾消光系數。固態吸收測試表明三者吸收邊延伸至1000 nm附近。動態粒徑分析顯示,聚集體尺寸隨fw增加呈先增大后減小趨勢。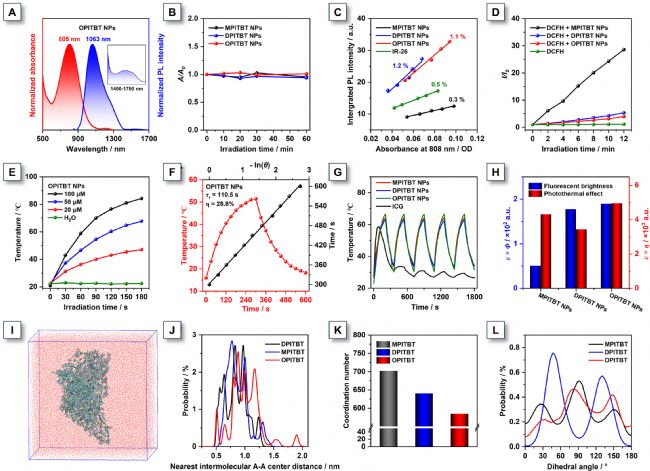
圖2. MPITBT NPs、DPITBT NPs、OPITBT NPs的光譜
為提升生物應用適用性,將MPITBT、DPITBT和OPITBT用DSPE-mPEG2000封裝成納米顆粒(NPs),并系統研究其光物理性質。由于聚集效應,三種NPs在808 nm處吸收紅移且消光系數提升:MPITBT NPs、DPITBT NPs和OPITBT NPs吸收峰分別位于814、779和805 nm(圖2A);其發射峰位于1100、1060和1063 nm處,因納米顆粒內部極性降低呈現微弱藍移。經808 nm激光(1 W cm⁻²)持續照射60分鐘后,NPs吸收強度衰減可忽略不計(圖2B),證實其卓越光穩定性。水溶液中三種NPs的NIR-II熒光量子產率(QY)分別為0.5%、1.2%和1.1%。值得注意的是,OPITBT NPs的QY較其四氫呋喃溶液狀態提升16倍,與該分子在AIE測試中的顯著熒光增強現象一致(圖2C)。鑒于NIR-II AIEgens在分子層面存在顯著非輻射能量耗散,評估了其NPs的光療性能:使用DCFH-DA檢測顯示,三者在808 nm激光照射下均具顯著ROS生成能力,其中MPITBT NPs效率最高(圖2D)。通過ABDA、DHR123和HPF特異性檢測證實,NPs主要通過I型光動力途徑產生超氧陰離子自由基(O₂•−),該途徑相比傳統II型PDT具有更低的氧依賴性優勢。在808 nm激光(0.8 W cm⁻²)照射3分鐘后,100 μM的MPITBT NPs、DPITBT NPs和OPITBT NPs溶液溫度分別飆升至76.7℃、70.3℃和84.3℃(圖2E),完全滿足腫瘤光熱消融需求。其中OPITBT NPs溫升高達63.3℃,顯著優于另兩種NPs(52.7℃和48.2℃),且光熱效應呈現濃度依賴性。OPITBT NPs的光熱轉換效率(PCE)達28.8%,為三者最高(圖2F)。經歷五次升降溫循環后,三種NPs的最高溫度保持穩定,而商用染料吲哚菁綠(ICG)則顯著衰減(圖2G),印證了其優異的光熱穩定性。
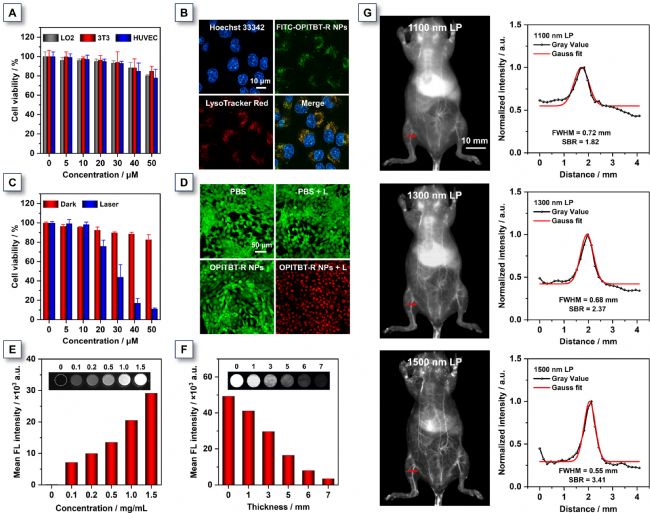
圖3. OPITBT-R NPs體外體內實驗
以LO2、3T3及HUVEC正常細胞評估生物相容性:即使 OPITBT-R NPs濃度達50 μM,細胞存活率仍超80%(圖3A),證明其良好生物安全性。共聚焦顯微鏡觀察顯示,FITC標記的OPITBT-R NPs在4T1癌細胞中與溶酶體探針高度共定位(皮爾遜相關系數=0.88),表明其通過溶酶體內吞途徑進入細胞(圖3B)。CCK-8實驗證實OPITBT-R NPs在黑暗條件下對4T1細胞毒性可忽略(圖3C);而在808 nm激光(0.8 W cm⁻²)照射下,50 μM濃度時細胞存活率驟降至10%,半數抑制濃度(IC₅₀)為28.81 μM。Calcein-AM/PI雙染實驗進一步驗證:僅"OPITBT-R NPs+激光"組呈現大面積紅色死細胞,其余對照組均顯示綠色活細胞(圖3D),證實其光控殺傷效能。基于OPITBT NPs優異熒光特性,研究者評估了OPITBT-R NPs的組織穿透能力:在808 nm激光激發下,其NIR-II熒光強度在特定濃度范圍內呈劑量依賴性(圖3E);即使覆蓋7 mm厚雞胸肉組織,1 mg mL⁻¹濃度時仍可檢測到明顯信號(圖3F)。小鼠血管成像顯示:隨長通濾波片波長增加,血管圖像分辨率顯著提升。在NIR-IIb區域(>1500 nm)觀察到極低背景噪聲,肝區周圍血管清晰可辨。1500 nm濾波下后肢血管成像信背比(SBR)達3.41,半峰全寬(FWHM)僅0.55 mm(圖3G);1400 nm濾波成像質量更優(SBR=3.53, FWHM=0.52 mm)。這歸因于OPITBT-R NPs在NIR-II區的卓越熒光亮度,且該波段水吸收峰反而增強了信背比,彰顯其強大的活體NIR-II成像能力。
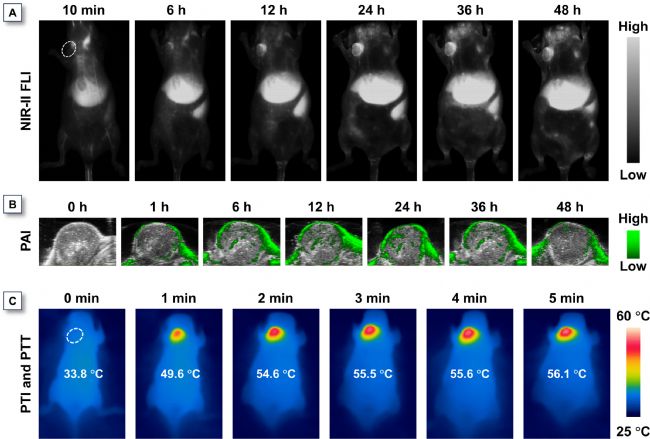
圖4. 注射OPITBT-R NPs后原位4T1乳腺癌荷瘤小鼠成像實驗
基于OPITBT-R NPs在體外展現的抗癌細胞光毒性及體內外NIR-II成像能力,研究者在原位4T1乳腺癌小鼠模型中評估了其多模態診療性能。靜脈注射后,腫瘤區域熒光信號逐漸增強,24小時達峰值并持續至48小時(圖4A),這種長效滯留特性有利于術中導航。與熒光成像結果一致,光聲(PA)信號同樣在24小時達到峰值(圖4B),證實熒光/光聲雙模態協同可實現精準腫瘤可視化診斷。選擇NPs富集峰值時段(注射后24小時)進行光熱治療:經808 nm激光(0.8 W cm⁻²)照射2分鐘,腫瘤溫度從33.8℃急劇升至54.6℃,5分鐘后達56.1℃(圖4C),完全滿足腫瘤消融需求。這種快速升溫特性可顯著縮短照射時間,最大限度降低對正常組織的光損傷。上述結果充分證明,兼具NIR-II熒光成像、光聲成像與光熱治療功能的OPITBT-R NPs是精準癌癥診療的理想制劑。
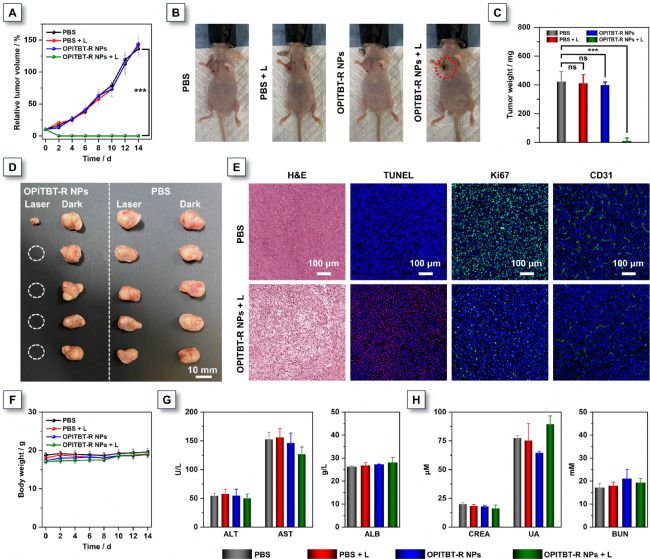
圖5. 腫瘤治療情況分析
基于前期實驗結果,對OPITBT-R NPs進行了體內抗腫瘤療效評估:將原位4T1乳腺癌荷瘤小鼠隨機分為四組。單次靜脈注射OPITBT-R NPs后24小時施加808 nm激光照射(0.8 W cm⁻²,5分鐘),光療組(OPITBT-R NPs + L)的實體瘤在2天內生長被完全抑制,腫瘤近乎消失(圖5A);治療14天后實現腫瘤完全清除且無復發跡象,僅殘留疤痕(圖5B)。相比之下,PBS組、PBS+L組及單獨納米顆粒組腫瘤持續快速生長(圖5C、D)。組織學與免疫組化分析進一步驗證作用機制:H&E染色顯示光療組腫瘤組織大面積破壞,而對照組腫瘤細胞存活且排列緊密;TUNEL染色證實光療組細胞嚴重凋亡/壞死;CD31與Ki67染色則表明腫瘤血管形成和細胞增殖受顯著抑制(圖5E)。治療期間每兩日監測小鼠體重,14天后光療組未出現顯著體重下降(圖5F)。治療結束時血液及主要器官分析顯示:光療組肝功指標(ALT/AST/ALB)與腎功指標(CREA/BUN)均無統計學差異(圖5G、H);心、肝、脾、肺、腎的H&E染色未見病理性異常,證實該納米系統具有優異的生物相容性與安全性,符合臨床光診療制劑標準。上述結果充分證明多維供體工程策略可開發兼具高效治療性與生物安全性的多功能光診療體系。
通過多維供體工程策略,本研究顯著提升了近紅外二區(NIR-II)診療試劑的熒光效率并優化其多模態光診療性能。所開發的NIR-II AIE分子OPITBT在納米聚集態下兼具高NIR-I摩爾消光系數、卓越的NIR-II量子產率、優異的光熱轉換效率及可接受的I型活性氧生成能力。系統性實驗與理論分析表明:該分子通過同步調控供體-受體強度、增強疏水相互作用、擴大分子堆疊距離減弱π-π堆積,并維持適度的分子內運動,實現了輻射衰變與非輻射衰變過程的精巧平衡。經納米化改性提升水分散性與腫瘤靶向能力后,OPITBT-R NPs表現出卓越的多模態診療性能:在NIR-II熒光/光聲/光熱成像引導下,通過光動力/光熱協同療法徹底清除小鼠原位4T1腫瘤。本研究為設計"一體化"光診療體系提供了通用框架,并為癌癥治療的臨床轉化奠定基礎。后續研究將聚焦OPITBT在深部惡性腫瘤、晚期動脈粥樣硬化病變及多重耐藥菌感染等臨床病理模型中的精準診療應用,以滿足轉化醫學的迫切需求。
參考文獻
Yuan T, Cui J, Zhu J, et al. Multi-dimensional donor engineering of NIR-II AIEgens for multimodal phototheranostics of orthotopic breast cancer[J]. Biomaterials, 2025, 319: 123193.
⭐️ ⭐️ ⭐️
動物活體熒光成像系統 - MARS
In Vivo Imaging System
高分辨率 - 定制高分辨大光圈紅外鏡頭,空間分辨率優于3um
熒光壽命 - 分辨率優于 5us
高速采集 - 速度優于1000fps (幀每秒)
多模態系統 - 可擴展X射線輻照、熒光壽命、光聲和光熱成像、原位成像光譜,CT等
顯微鏡 - 高分辨顯微成像系統,兼容成像型光譜儀
⭐️ ⭐️ ⭐️
恒光智影
上海恒光智影醫療科技有限公司,被評為“國家高新技術企業”,“上海市專精特新中小企業”,榮獲“科技部重大儀器專項立項項目”,上海市“科技創新行動計劃”科學儀器領域立項單位。
恒光智影,致力于為生物醫學、臨床前和臨床應用等相關領域的研究提供先進的、一體化的成像解決方案。
專注動物活體成像技術,成像范圍覆蓋 400-1700 nm,同時可整合CT, X-ray,超聲,光聲,光熱成像等技術。
可為腫瘤藥理、神經藥理、心血管藥理、大分子藥代動力學等一系列學科的科研人員提供清晰的成像效果,為用戶提供前沿的生物醫藥與科學儀器服務。





