賽多利斯推出一體化上游工藝平臺connect upstream
Connect Upstream:加速進入臨床
— 從DNA到進入臨床的研發周期縮短至14個月以內

隨著全球醫藥市場規模的逐年擴大,新藥研發所面臨的挑戰也更加艱巨。在確保產品質量的前提下,降低研發成本、縮短在研項目的研發周期、加速推進項目進入臨床是藥物研發企業應對激烈競爭的重要手段。
賽多利斯Cellca技術平臺擁有無需專利授權費用的CHO宿主細胞株,能夠實現較高的表達量,同時減少客戶自身對培養基和工藝優化的需求,目前Cellca已經完成了超過40個項目的研發工作,大部分項目表達量超過3g/L。結合賽多利斯BioOutsource技術平臺提供的100多項經過官方預先驗證的檢測分析方法,將進一步加速項目進程。
賽多利斯還擁有高度自動化的微型生物反應器系統,以便更高效地推動在研項目的進程。ambr® 15微型生物反應器系統(圖1a)可以在克隆篩選后期綜合研究克隆篩選、培養基優化以及初步工藝開發等內容。 ambr® 250微型生物反應器系統(圖1b)和BIOSTAT STR®一次性生物反應器系列有著高度的幾何一致性,可以極大地簡化工藝放大的計算和驗證過程。

圖一:微型生物反應器縮短上游工藝開發時間
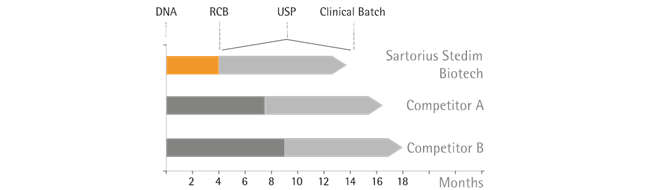
圖二:Cellca 和BioOutsource 平臺縮短項目早期開發時間
• 加速進入臨床
快速進入臨床階段至關重要,合適的工具和測試服務將使您能以最短的時間和最少的成本快速開發出細胞系和相關工藝。
在Connect Upstream平臺上,Cellca®技術平臺擁有無需專利授權的宿主細胞和質粒系統,為客戶提供從DNA到RCB的服務。而BioOutsource®技術平臺提供的100多項經過官方預先驗證的檢測分析手段則為客戶完成藥物一致性評價以及細胞庫檢定服務。ambr®15先進的微型生物反應器系統可以在克隆篩選階段實現快速獲得高表達克隆株、最優培養基及初步放大工藝等。ambr®250微型生物反應器系統可以實現系統的進行工藝開發,工藝優化及工藝驗證,ambr®250系統和BIOSTAT® STR一次性生物反應器系列有著高度幾何一致性,發酵工藝可以在不同的反應器之間進行工藝放大或工藝縮小驗證,極大地簡化了工藝放大的計算和驗證過程。有實例表明,生物制藥企業利用此類一次性微型生物反應器及一次性攪拌式生物反應器將新藥申報項目周期從原計劃的22周縮短到16周。從小試研發的微型生物反應器到生產規模的BIOSTAT® STR生物反應器,所有這些成員就是我們實現此“加速進入臨床”戰術的核心組成。
• 提高表達量
通過優化工藝提高您的表達量,快速進入臨床試驗。choptimizer®所特有的解決方案將幫助您找到最佳的培養基混合物、最優的工藝參數以及成功的補料策略。
在抗體上游工藝開發中,表達量對于產品投入生產十分重要。按照當今現代抗體生產制造的要求,能夠穩定在生產規模達到3g/L左右的水平,將可以大大節省廠房和設備的投資。在Connect Upstream平臺中,將會有著三位明星角色完成工藝的“后勤保障”工作。原型培養基、高通量微型生物反應器ambr® 15以及BIOPAT® MODDE實驗設計軟件,三者的配合使用,相輔相成,既能夠將ambr®全自動高通量的特點發揮到極致,又能夠使用DoE設計好的實驗方案找到最佳培養條件。賽多利斯為客戶提供的培養基優化服務CHOptimizer®,能夠為客戶提供具有完全配方的特異性的基礎培養基、補料培養基以及對應的補料策略。有許多案例表明,系統進行培養基優化及工藝優化,不但能夠實現產量提高5-10倍,而且,能夠有效改善產品質量,如糖基化水平,電荷分布等。
• 質量源于設計
從細胞系到商業化生產,不同規模間的恰當轉換很有必要。運用正確的qbd策略,將有助于您實現穩健、高效和可追溯的工藝。
在現代藥物開發過程中,質量源于設計的理念已經成為行業的標準。在Connect Upstream平臺上,同樣需要強有力的“二傳手”來完成工藝開發中關鍵的一步。ambr® 250是工藝開發中的利器,其設計與傳統反應器一致,能確保工藝的可放大性。而MFCS軟件是符合CFR Part11的SCADA系統,在上游工藝中無論是實驗規模還是生產規模,它都是數據的大腦。SMICA MVDA多變量分析軟件能夠幫助用戶在進入生產后,建立數據模型從而持續提高生產管理和生產工藝水平。再加上目前行業的熱門選手,一次性生物反應器BIOSTAT STR®系列,這些成員便確保了從開發到生產,始終嚴格遵循QbD的理念。
• 穩健生產
為了實現長期穩健的生產,您需要靈活且具備成本效益的生物制造平臺。我們的完整解決方案團隊將以無與倫比的專業知識,為您設計、交付并構建這樣的平臺。
當完成了藥物的工藝開發,進入商業化生產時,我們同樣要考慮工藝的穩定性。賽多利斯完整解決方案團隊將他們的專業知識應用于客戶的工藝開發、廠房設計和合規需求,幫助用戶建造一個穩健的生產設施,確保將小試或中試的工藝,安全無憂地轉移到大規模的商業化生產中。
參與賽多利斯推出的Connect Upstream活動之“加速進入臨床”,了解國內外知名制藥企業如何加快藥物研發的進程。查看詳情
- 迪必爾入選2025關鍵技術研發計劃"合成生物學"項目
- 美國國立衛生研究院宣布停止對僅動物研究的資助
- 智聽自然,聲動未來:沃德精準亮相"聲景中國"研討會
- 赫西智能高速冷凍離心機亮相央視"革新人工催產技術"
- 易科泰榮膺“SFAA 植物工廠應用十大優秀企業”稱號
- 百蓁生物推出一站式高精度HDX-MS分析服務
- 10x Chromium GEM-X動物及畜牧類研究獎勵計劃啟動
- 生物芯片空間多組學平臺再添一臺CosMx SMI成像系統
- PicoQuant顯微鏡助力開發高效單光子發射源二維材料
- 安捷倫與北師大共建大灣區污水流行病學聯合實驗室
- 客戶專訪:RAYPA培養基制備器使用心得與經驗分享
- 美森攜CTCC細胞庫與干細胞技術亮相東南大學高研院
- 赫西儀器參與起草國標《實驗室離心機》條例
- Biotech DEGASi®脫氣腔助力水性液體高效脫氣
- 祝賀BMG斬獲SelectScience科學家選擇獎行業殊榮
- QD中國攜單細胞方案亮相國際干細胞研究學會年會
- 2025干細胞臨床應用學術交流會通知
- 直播預告:Celloger活細胞成像系統在類器官中的應用
- 澤匯生物成為安捷倫北京區細胞分析線產品核心代理商
- NGDx第十屆先進診斷技術開發論壇首批嘉賓重磅揭曉
- 第二屆RNA World 2025國際論壇通知
- 安捷倫推出XF Flex分析儀:3D組織與類器官研究新紀元
- NGDx2025第十屆先進診斷技術開發與應用論壇通知
- 森西賽智亮相中國衰老科學大會暨國際衰老生物學大會
- 2025 第十八屆細胞產業大會(深圳)通知
- 安捷倫xCELLigence實時細胞分析助力Autolus獲批
- 2025 第十七屆(上海)細胞產業大會今日盛大開幕
- 丹納赫北部創新中心亮相,合成生物研討會圓滿舉辦
- 美谷分子邀您參加第四屆中醫藥多學科交叉技術沙龍
- 瑞孚迪將攜ADC前沿應用方案亮相2025 BIOCHINA大會






